|
||||
|
III. Аналитическая химия 1. Теоретические основы аналитической химии Чувствительность аналитической реакции. Предел обнаружения, или открываемый минимум, (m) – наименьшая масса вещества, открываемая данной реакцией по данной методике. Измеряется в микрограммах (1 мкг = 10– 6 г). Предельная концентрация (clim) – наименьшая концентрация определяемого вещества, при которой оно может быть обнаружено в растворе данной реакцией по данной методике. Выражается в г/мл. Предельное разбавление (Vlim) – объем раствора с предельной концентрацией, в котором содержится 1 г определяемого вещества. Предельное разбавление выражается в мл/г. 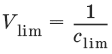 Минимальный объем предельно разбавленного раствора (Vmin) – наименьший объем (мл) раствора определяемого вещества, необходимый для его обнаружения данной реакцией. m = Clim • Vmin • 106, 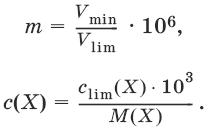 Вычисление рН водных растворов Вычисление рН водных растворов сильных кислот: рН = – lga(H+) = – lg (c(H+) / f(Н+)) сильных оснований: рН = 14 + lga(OH?) = 14 + lg (c(OH?) f(OH?)) слабых кислот: рН = – ?(рKкислоты – lgc) = – ?Kкислоты – ?lgc слабых оснований: рН = 14 – ?рKоснования + ?lgc солей, образованных сильным основанием и слабой кислотой: рН = 7 + ?pKкислоты + ?lgcсоли солей, образованных слабым основанием и сильной кислотой: рН = 7 – ?Kоснования – lgcсоли солей, образованных слабым основанием и слабой кислотой: рН = 7 + ?pKкислоты + ?pKоснования кислого буферного раствора: 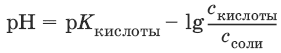 щелочного буферного раствора: 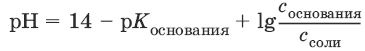 Вычисление буферной емкости. Емкость буферного раствора определяется количеством сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферного раствора, чтобы изменить его значение рН на единицу. 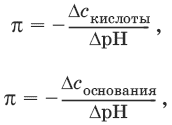  Гетерогенное равновесие: осадок – насыщенный раствор малорастворимого соединения. Гетерогенное равновесие между осадком малорастворимого соединения и его ионами в насыщенном водном растворе может быть представлено следующим уравнением: KtmAnnv - mKtn+ + nAnm- [Ktn+] = m s; [Anm-] = n • s Константа равновесия обратимой реакции осаждения-растворения называется произведением растворимости Ks (или ПР) и выражается следующим образом: Ks = a(Ktn+)m a(Anm-)n = (f(Ktn+) x [Ktn+])m • (f(Anm-)[Anm-])n = (ms)m(ns)n • f(Ktn+)m • f(Ann-)n = nnmmsm+n • f(Ktn+)m • f(Anm-)n, или Ks = nn • mm • sm + n Растворимость – это свойство вещества образовывать гомогенные системы с растворителем. Молярная растворимость малорастворимого вещества (s), моль/л, выражается следующим образом: 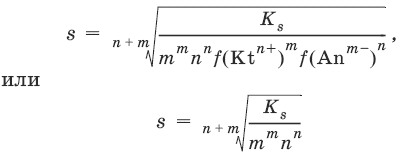 Зная молярную растворимость соединения KtmAnn, легко вычислить его растворимость в г/л ? по формуле: ? = s • M(KtmAnn) Массу малорастворимого вещества в любом объеме можно рассчитать по формуле: m(KtmAnn) = s(KtmAnn) • M(KtmAnn) x Vр-ра Условие образования и растворения осадка. Осадок не образуется или растворяется, если произведение концентраций ионов осадка в растворе меньше величины произведения растворимости. [Ktn+]m[Anm-]n < Ks(KtmAnn) Осадок образуется или выпадает, если произведение концентраций ионов осадка в растворе больше величины произведения растворимости. [Ktn+]m[Anm-]n > Ks(KtmAnn). Равновесия в окислительно-восстановительных системах. Для обратимой окислительно-восстановительной реакции Oх + ne - Red Равновесный потенциал Eox/red со стандартным потенциалом редокс-пары Eox/red и активностью окисленной и восстановленной формы связан уравнением Нернста: 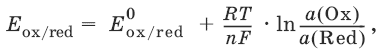 где R – универсальная газовая постоянная, равная 8,314 Дж/моль К, Т – температура по шкале Кельвина, К, T – число Фарадея, равное 96485 Кл/моль, а(Ох) – активность окисленной формы, a(Red) – активность восстановленной формы. При подстановке в уравнение значений универсальной газовой постоянной, числа Фарадея, температуры Т = 298 К и замены натурального логарифма на десятичный получается уравнение для расчета значения равновесного электродного потенциала редокс-пары при 25°C: 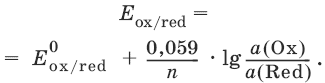 Если в окислительно-восстановительных реакциях принимают участие ионы водорода, то уравнение Нернста выглядит следующим образом: 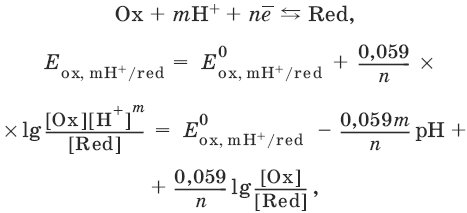 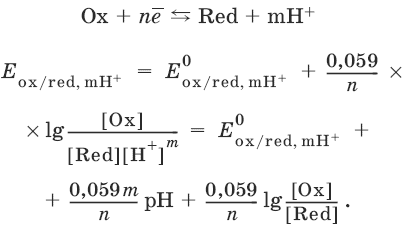 Если окисленная или восстановленная форма окислительно-восстановительной полуреакции является малорастворимым соединением, то в формулу для вычисления равновесного потенциала такой системы входит величина произведения растворимости этого соединения. 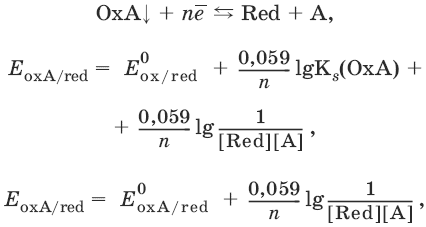 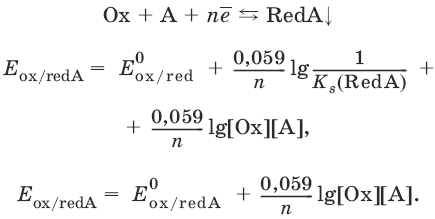 Если в окислительно-восстановительной полуреакции окисленной формой является комплексное соединение OxLm, характеризующееся константой устойчивости ?(OxLm), то равновесный окислительно-восстановительный потенциал вычисляется по уравнению: 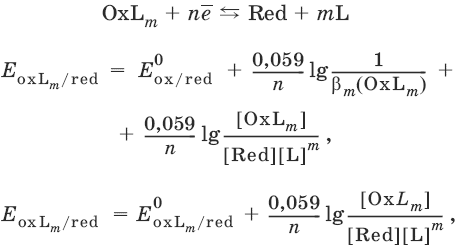 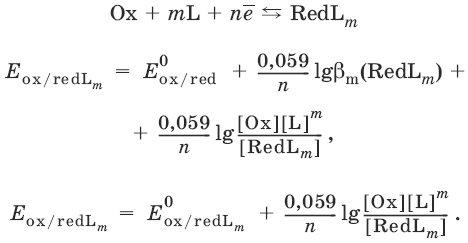 Направление и глубина протекания окислительно-восстановительных реакций. Обратимая окислительно-восстановительная реакция аОх1 + bRed1 - аОх2 + bRed2 протекает в прямом направлении, если ?Е0 = Е0Ox1/Red2 – Е0Ox2/Red1 > 0, И В обратном направлении, если ?Е0 < 0. Глубина протекания реакции, т. е. степень превращения исходных веществ в продукты реакции, определяется константой равновесия. Для окислительно-восстановительной реакции константа равновесия с потенциала- ми участвующих в реакции редокс-пар связана уравнением: 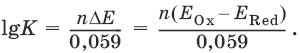 2. Качественные реакции катионов Кислотно-основная классификация катионовI группа: Li+, NH4+, Na+, K+ групповой реагент – отсутствует. Свойства соединений: хлориды, сульфаты и гидроксиды растворимы в воде. II группа: Ag+, Hg22+, Pb2+ групповой реагент – HCl (с(HCl) = 2 моль/л). Свойства соединений: хлориды не растворимы в воде. III группа: Са2+, Ва2+, Sr2+, Pb2+ групповой реагент – H2SO4 (c(H2SO4) = 2 моль/л). Свойства соединений: сульфаты не растворимы в воде. IV группа: Al3+, Cr3+, Zn2+, As(III), As(IV), Sn2+ групповой реагент – NaOH (c(NaOH) = 2 моль/л), избыток. Свойства соединений: гидроксиды растворимы в избытке NaOH. V группа: Bi3+, Fe2+, Fe3+, Mn2+ групповой реагент – NH3 (конц.). Свойства соединений: гидроксиды нерастворимы в избытке NaOH и NH3. VI группа: Cd2+, Co2+, Cu2+, Ni2+ групповой реагент – NH4OH (конц.). Свойства соединений: гидроксиды нерастворимы в избытке NaOH, но растворимы в избытке NH3. 2.1. I аналитическая группа Ион: Li+1. Реактив, условия: Na2HPO4, конц. NH3. Уравнение реакции: 3LiCl + Na2HPO4 = Li3PO4v + 2NaCl +HCl Наблюдения: белый осадок. 2. Реактив, условия: Na2CO3, рН ? 7 Уравнение реакции: 2LiCl + Na2CO3 = Li2CO3v + 2NaCl Наблюдения: белый осадок. Ион: NH4+1. Реактив, условия: NaOH, газовая камера. Уравнение реакции: NH4Cl + NaOH = NaCl + Н2O + NH3^ Наблюдения: запах аммиака, фенолфталеиновая бумага краснеет. 2. Реактив, условия: реактив Несслера (смесь K2[HgI4] и KOH) Уравнение реакции: NH3 + 2K2[HgI4] + ЗKOH = [OHg2NH2]Iv + 7KI + 2Н2O Наблюдения: красно-бурый осадок. Ион: Na+1. Реактив, условия: K[Sb(OH)6], насыщенный раствор, холод, рН ? 7, мешают NH4+, Li+ Уравнение реакции: NaCl + K[Sb(OH)6] = Na[Sb(OH)6]v + KCl Наблюдения: белый осадок. 2. Реактив, условия: Zn(UO2)3(CH3COO)8, предметное стекло, CH3COOH, мешает Li+ Уравнение реакции: NaCl + Zn(UO2)3(CH3COO)8 + CH3COOK + 9Н2O = NaZn(UO2)3(CH3COO)9 9Н2Ov + KCl Наблюдения: желтые кристаллы октаэд-рической и тетраэдрической форм. Ион: К+1. Реактив, условия: Na3[Co(NO2)6], слабо-кислая среда, мешают NH4+, Li+. Уравнение реакции: 2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]v + 2NaCl Наблюдения: желтый осадок. 2. Реактив, условия: NaHC4H4O6, рН ? 7, мешает NH4+. Уравнение реакции: 2KCl + NaHC4H4O6 = K2C4H4O6v + NaCl + HCl Наблюдения: белый осадок. 2.2. II аналитическая группа Ион: Ag+1. Реактив, условия: HCl, NH3 • Н2O Уравнения реакций: AgNO3 + HCl = AgClv + HNO3 AgClv + 2NH3 • H2O = [Ag(NH3)2]Cl + 2H2O [Ag(NH3)2]Cl + 2HNO3 = AgClv + 2NH4NO3 Наблюдения: белый осадок, растворимый в избытке аммиака и выпадающий вновь при добавлении азотной кислоты (использовать спец. слив!). 2. Реактив, условия: К2СrO4, рН = 6,5–7,5. Уравнение реакции: 2AgNO3 + K2CrO4 = Ag2CrO4v + 2KNO3 Наблюдения: кирпично-красный осадок. Ион: Hg2+1. Реактив, условия: HCl, NH3 • Н2O Уравнения реакций: Hg2(NO3)2 + 2HCl = Hg2Cl2v + 2HNO3 Hg2Cl2v + 2NH3 • H2O = [HgNH2]Clv + Hgiv + NH4Cl + 2H2O Наблюдения: белый осадок, при добавлении аммиака – чернеет (использовать спец. слив!). 2. Реактив, условия: Cu (металл.) Уравнение реакции: Hg2(NO3)2 + Cu = Hgv + Cu(NO3)2 Наблюдения: образование амальгамы. Ион: РЬ2+1. Реактив, условия: HCl Уравнение реакции: Pb(NO3)2 + 2HCl = РЬCl2v + 2HNO3 Наблюдения: белый осадок, растворимый в горячей воде. 2. Реактив, условия: KI Уравнение реакции: РЬCl2 + 2KI = РCl2v + 2KCl Наблюдения: ярко-желтый осадок. 2.3. III аналитическая группа Ион: Ва2+1. Реактив, условия: H2SO4 Уравнение реакции: ВaCl2 + H2SO4 = BaSO4v + 2HCl Наблюдения: белый осадок, нерастворимый в HNO3. 2. Реактив, условия: К2СrO4 или К2Сr2O7 Уравнение реакции: ВaCl2 + К2СrO4 = ВаСrO4v + 2KCl Наблюдения: желтый осадок, нерастворимый в CH3COOH, растворимый в HNO3. Ион: Са2+1. Реактив, условия: H2SO4 и С2Н5OH Уравнение реакции: CaCl2 + H2SO4 + 2Н2O = CaSO4 • 2H2Ov + 2HCl Наблюдения: белые кристаллы гипса. 2. Реактив, условия: (NH4)2C2O4 Уравнение реакции: CaCl2 + (NH4)2C2O4 = СаС2O4v + 2NH4Cl Наблюдения: белый осадок, нерастворимый в CH3COOH, растворимый в HNO3. Ион: Sr2+1. Реактив, условия: «гипсовая вода» Уравнение реакции: SrCl2 + CaSO4 >t> SrSO4v + CaCl2 Наблюдения: белый осадок. 2.4. IV аналитическая группа Ион: Al3+1. Реактив, условия: ализарин С14Н6O2(OH)2, NH3 • Н2O (NH4Cl) Уравнения реакций: AlCl3 + 3NH3 • H2O = Al(OH)3v + 3NH4Cl 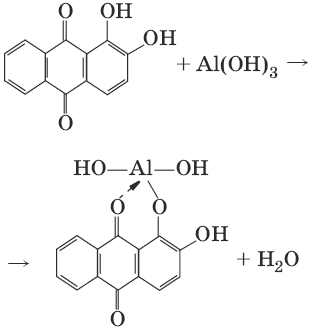 Наблюдения: Розовый лак на фильтровальной бумаге. 2. Реактив, условия: алюминон, CH3COOH Уравнение реакции: алюминон с Al(OH)3 образует красный лак, которому приписывается следующая формула: 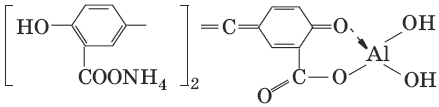 Наблюдения: розовый лак. Ион: Сr3+Реактив, условия: NaOH, H2O2, нагревание, амиловый спирт, H2SO4 Уравнение реакции: 2СrCl3 + 10NaOH + ЗН2O2 = 2К2СrO4 + 6NaCl + 8Н2O Наблюдения: желтый раствор, при добавлении амилового спирта, H2SO4 наблюдается синее кольцо. Ион: Zn2+Реактив, условия: дитизон С6Н5—NH—N=C(SH)—N=N—C6H5 (дифенилкарбазон), CHCl3, рН = 2,5-10, мешают Pb2+, Cd2+, Sn2+ Уравнения реакций: 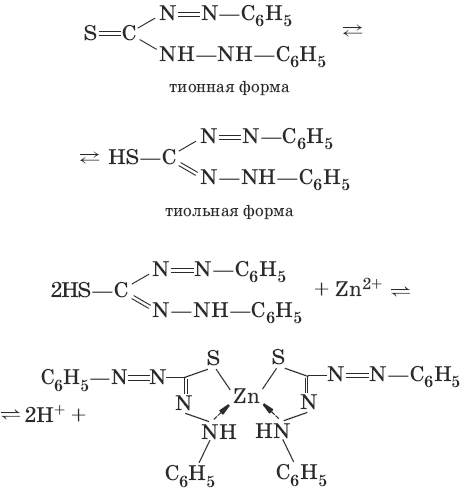 Наблюдения: соль красного цвета, растворимая в хлороформе (CHCl3). Ион: AsO33-Реактив, условия: AgNO3 Уравнение реакции: Na3AsO3 + 3AgNO3 = Ag3AsO3v + 3NaNO3 Наблюдения: желтый аморфный осадок, растворим в концентрированном растворе аммиака и в азотной кислоте (использовать спец. слив!). Ион: AsO43-1. Реактив, условия: магнезиальная смесь (MgCl2 + NH4Cl + NH3), мешает PO43- Уравнение реакции: NH4Cl + MgCl2 + Na3AsO4 = NH4MgAsO4v + 3NaCl Наблюдения: белый кристаллический осадок (использовать спец. слив!). 2. Реактив, условия: AgNO3 Уравнение реакции: Na3AsO4 + 3AgNO3 = Ag3AsO4v + 3NaNO3 Наблюдения: осадок шоколадного цвета (использовать спец. слив!). 3. Реактив, условия: (NH4)2S или H2S, конц. HCl Уравнение реакции: 5H2S + 2Na3AsO4 + 6HCl = As2S5v + 8Н2O + 6NaCl Наблюдения: осадок желтого цвета (использовать спец. слив!). Ион: Sn2+1. Реактив, условия: Bi(NO3)3, pH > 7 Уравнения реакций: SnCl2 + NaOH = Sn(OH)2v + 2NaCl Sn(OH)2 + 2NaOH(изб.) = Na2[Sn(OH)4] + 2NaCl 3Na2[Sn(OH)4] + 2Bi(NO3)3 + 6NaOH = 2Bi + 3Na2[Sn(OH)6] + 6NaNO3 Наблюдения: осадок черного цвета. 2. Реактив, условия: HgCl2, конц. HCl Уравнения реакций: SnCl2 + 2HCl = H2[SnCl4] H2[SnCl4] + 2HgCl2 = H2[SnCl6] + Hg2Cl2v Наблюдения: осадок белого цвета, который постепенно чернеет вследствие образования металлической ртути. 2.5. V аналитическая группа Ион: Bi3+1. Реактив, условия: Na2[Sn(OH)4], pH >7 Уравнение реакции: 2Bi(NO3)3 + 3Na2[Sn(OH)4] + 6NaOH = 2Biv + 3Na2[Sn(OH)6] + 6NaNO3 Наблюдения: осадок черного цвета. 2. Реактив, условия: KI, рН < 7 Уравнение реакции: Bi(NO3)3 + 3KI = Bil3v + 3KNO3 Наблюдения: осадок черного цвета, растворяется в избытке KI с образованием оранжевого раствора K[BiI4]. При разбавлении водой опять выпадает черный осадок BiI3, который затем гидролизуется с образованием оранжевого осадка ВiOI. Ион: Fe2+1. Реактив, условия: K3[Fe(CN)6] Уравнение реакции: FeSO4 + K3[Fe(CN)6] = KFe[Fe(CN)6]v + K2SO4 Наблюдения: темно-синий осадок турн-булевой сини. Ион: Fe3+1. Реактив, условия: K4[Fe(CN)6] Уравнение реакции: FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]v + ЗKCl Наблюдения: темно-синий осадок берлинской лазури. 2. Реактив, условия: NH4CNS, мешают ионы NO2? Уравнение реакции: FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl Наблюдения: кроваво-красный раствор. Ион: Mn2+1. Реактив, условия: NaBiO3(крист.), HNO3 Уравнение реакции: 2Mn(NO3)2 + 14HNO3 + 5NaBiO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O Наблюдения: малиново-фиолетовая окраска раствора. 2.6. VI аналитическая группа Ион: Cd2+1. Реактив, условия: NH4OH Уравнения реакций: Cd(NO3)2 + 2NH4OH = Cd(OH)2v + 2NH4NO3 Cd(OH)2v + 4NH4OH = [Cd(NH3)4](OH)2 + 2H2O Наблюдения: осадок белого цвета, растворим в избытке водного раствора аммиака. 2. Реактив, условия: (NH4)2S, pH > 0,5 Уравнение реакции: Cd(NO3)2 + (NH4)2S = CdSv + 2NH4NO3 Наблюдения: желто-оранжевый осадок. Ион: Со2+Реактив, условия: NH4CNS, изоамиловый спирт (смесь изоамилового спирта с эфиром), мешают ионы Fe3+. Для удаления мешающих ионов Fe3+ добавляют NH4F. Уравнение реакции: СоCl2 + 4NH4CNS = (NH4)2[Co(SCN)4] + 2NH4CNS Наблюдения: слой органических реагентов окрашен в синий цвет. Ион: Cu2+Реактив, условия: NH3 Н2O, избыток Уравнение реакции: CuSO4 + 4NH3 H2O = [Cu(NH3)4]SO4 + 4Н2O Наблюдения: темно-синий раствор. Ион: Ni2+Реактив, условия: диметилглиоксим C4H8N2O2 (реактив Чугаева), KOH, рН ? 9-10 Уравнение реакции: 2C4H8N2O2 + Ni2+ = Ni(C4H6N2O2)2 + 2H+ Наблюдения: розовый осадок. 3. Качественные реакции анионов Кислотно-основная классификация анионов I группа: SO42-, CO32-, PO43-, SiO32- групповой реагент – Ba(NO3)2 II группа: CI?, S2- групповой реагент – AgNO3 III группа: NO3?, MoO42-, WO42-, VO3?, CH3COO? групповой реагент – отсутствует 3.1. I аналитическая группа Ион: SO42-1. Реактив, условия: Ba(NO3)2 Уравнение реакции: SO42- + Ba(NO3)2 = BaSO4v + 2NO3? Наблюдения: белый осадок, нерастворим в HNO3. Ион: CO32-1. Реактив, условия: Ba(NO3)2 Уравнения реакций: CO32- + Ba(NO3)2 = ВaCO3v + 2NO3? ВaCO3v + 2Н+ = Ва2+ + CO2^ + Н2O Наблюдения: белый осадок, легко растворимый в соляной, азотной и уксусной кислотах с выделением оксида углерода(IV) CO2. 2. Реактив, условия: минеральные кислоты (HCl, HNO3, H2SO4), известковая вода (Са(OH)2). Уравнения реакций: CO32- + 2H+ = CO2^ + Н2O Са(OH)2 + CO2 = CaCO3v + Н2O Наблюдения: выделение газа, помутнение известковой воды. Ион: PO43-1. Реактив, условия: Ba(NO3)2 Уравнение реакции: Na3PO4 + Ba(NO3)2 = Ba3(PO4)2v + 2NaNO3 Наблюдения: белый осадок, растворимый в минеральных кислотах. 2. Реактив, условия: молибденовая жидкость, раствор молибдата аммония (NH4)2MoO4 в азотной кислоте, NH4NO3 Уравнение реакции: PO43- + 3NH4+ + 12МоO42- + 24Н+ = (NH4)3[P(Mo3O10)4]v + 12Н2O Наблюдения: желтый кристаллический осадок. Ион: SiO32-1. Реактив, условия: разбавленные растворы кислот. Уравнение реакции: SiO32- + 2H+ = H2SiO3v Наблюдения: образование геля кремниевой кислоты. 2. Реактив, условия: соли аммония (NH4Cl, или (NH4)2SO4, или NH4NO3). Уравнение реакции: SiO32- + 2NH4+ + (2Н2O) = H2SiO3v + 2NH3 + (2Н2O) Наблюдения: образование геля кремниевой кислоты. 3.2. II аналитическая группа Ион: Cl?Реактив, условия: AgNO3, NH4OH, HNO3. Уравнения реакций: Ag+ + CI? = AgClv AgClv + 2NH4OH = [Ag(NH3)2]Cl + 2H2O [Ag(NH3)2]Cl + 2HNO3 = AgClv + 2NH4NO3 Наблюдения: белый осадок, растворим в NH4OH, образуется в HNO3. Ион: S2-1. Реактив, условия: разбавленные растворы кислот, фильтровальная бумага, смоченная ацетатом свинца РЬ2(CH3COО)2. Уравнения реакций: S2- + 2Н+ = H2S^ H2S^ + Pb2+ + 2CH3COО? = PbSv + 2CH3COOH Наблюдения: резкий запах, почернение фильтровальной бумаги, смоченной ацетатом свинца. 2. Реактив, условия: соли сурьмы(III), Sb2S3 Уравнение реакции: 3S2- + 2Sb3+ = Sb2S3v Наблюдения: оранжевый осадок. 3. Реактив, условия: соли кадмия(II), Cd(NO3)2 Уравнение реакции: S2- + Cd2+ = CdSv Наблюдения: желтый осадок. 3.3. III аналитическая группа Ион: NO3?Реактив, условия: дифениламин (C6H5)2NH в H2SO4 (конц.) Наблюдения: темно-синее окрашивание на стенках пробирки. Ионы: МoO42-, WO42-, VO3?Реактив, условия: дифениламин (C6H5)2NH в H2SO4 (конц.) Наблюдения: темно-синее окрашивание на стенках пробирки. Ион: VO3?1. Реактив, условия: Н2O2, эфир. Уравнение реакции: VO3? + Н2O2 = VO4? + Н2O Наблюдения: окрашивание органической фазы в оранжевый цвет. 2. Реактив, условия: лигнин (газетная бумага) Наблюдения: лигнин, содержащийся в газетной бумаге, восстанавливает ион VO3? до низших степеней окисления, которые окрашивают газетную бумагу в черно-зеленый цвет. Ион: CH3COО?Реактив, условия: H2SO4 (конц.) Уравнение реакции: CH3COО? + Н+ = CH3COOH Наблюдения: запах уксуса. 4. Количественный анализ 4.1. Титриметрический (объемный) анализ Молярная концентрация сэ = nэ/V, где nэ – количество вещества эквивалентов, моль; V– объем раствора, л; единица измерения концентрации – моль/л. Количество вещества эквивалента (nэ) nэ = m/Mэ = cэ V, где m – масса вещества, г; Mэ – молярная масса эквивалента, г/моль, V – объем раствора, л. Закон эквивалентов: nэ(А) = nэ(В) или 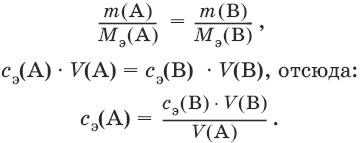 Титр – количество граммов растворенного вещества, содержащегося в 1 мл раствора. 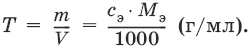 Титр по определяемому веществу – количество граммов определяемого вещества, которое реагирует с 1 мл титранта. 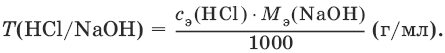 Прямое титрование – простейший прием титрования, заключающийся в том, что к определенному объему раствора определяемого вещества (А) по каплям приливают титрант (рабочий раствор) вещества (В). 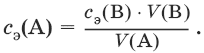 Обратное титрование – процесс титрования, при котором к определенному объему раствора определяемого вещества (А) приливают точно известный объем титранта (В1), взятого в избытке. Избыток не вошедшего в реакцию вещества (В1) оттитровывают раствором другого титранта (В2) точно известной концентрации. 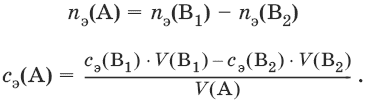 Заместительное титрование. Процесс титрования, при котором к определяемому веществу (А) прибавляют вспомогательное вещество (Р), реагирующее с ним с выделением эквивалентного количества нового вещества (А1), которое оттитровывают соответствующим титрантом (В). Таким образом, вместо непосредственного титрования определяемого вещества (А) титруют его заместитель (А1). Так как количества A и A1 эквивалентны, то количество вещества эквивалента определяемого вещества nэ(А) равно количеству вещества эквивалента титранта nэ(В): 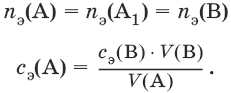 4.2. Метод нейтрализации Уравнение реакции: Н+ + OH? > Н2O или Н3O+ + OH? > 2Н2O. Основные титранты (рабочие растворы): растворы сильных кислот (HCl или H2SO4) и сильных оснований (NaOH или KOH). Установочные вещества (или первичные стандарты): тетраборат натрия Na2B4O7 ? 10 Н2O, карбонат натрия Na2CO3, щавелевая кислота Н2С2O4 • 2Н2O, янтарная кислота Н2С4Н4O4. Индикаторы: кислотно-основные индикаторы (см. таблицу). Характеристики некоторых индикаторов приведены в таблице.   Некоторые примеры кислотно-основного титрования Некоторые примеры кислотно-основного титрования Титрование сильной кислоты сильным основанием HCl + NaOH > NaCl + Н2O Н+ + OH? > Н2O В точке эквивалентности образуется соль сильной кислоты и сильного основания, которая не подвергается гидролизу. Реакция среды будет нейтральной (рН = 7). В данном случае индикатором может служить лакмус. Титрование слабой кислоты сильным основанием CH3COOH + NaOH > CH3COONa + Н2O CH3COOH + OH? – > CHgCOO? + Н2O Образующаяся соль слабой кислоты и сильного основания в растворе подвергается гидролизу: CH3COO? + HOH > CH3COOH + OH? Точка эквивалентности в этом случае будет находиться в щелочной среде, поэтому следует применять индикатор, меняющий окраску при рН < 7, например фенолфталеин. Титрование слабого основания сильной кислотой NH4OH + HCl > NH4Cl + Н2O NH4OH + Н+ > NH4+ + Н2O Образующаяся соль в растворе подвергается гидролизу: NH4+ + HOH > NH4OH + Н+ Точка эквивалентности будет находиться в кислой среде, поэтому можно применять индикатор, меняющий свою окраску при рН < 7, например метилоранж. 4.3. Метод комплексонометрии Комплексонометрия – титриметриче-ский метод анализа, основанный на реакциях комплексообразования определяемых ионов металлов с некоторыми органическими веществами, в частности с комплексонами. Комплексоны – аминополикарбоновые кислоты и их производные (соли). В титриметрическом анализе широко используется один из представителей класса комплексонов – динатриевая соль этилендиаминтетрауксусной кислоты (Ма2Н2ЭДТА). Этот комплексон часто называют также трилоном Б или комплексном III: 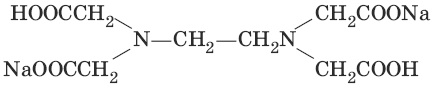 или [Na2H2ЭДTA] или [Na2H2ЭДTA] Трилон Б со многими катионами металлов образует прочные, растворимые в воде внутрикомплексные соединения (хелаты). При образовании хелата катионы металла замещают два атома водорода в карбоксильных группах трилона Б и образуют координационные связи с участием атомов азота аминогрупп. Уравнение реакции: Ме2+ + Н2ЭДТА2- > [МеЭДТА]2- + 2Н+ Основные титранты (рабочие растворы): трилон Б, MgSO4, CaCl2 Установочные вещества (или первичные стандарты): MgSO4, CaCl2 Индикаторы: металлохромные индикаторы, эриохром черный Т При рН = 7-11 анион этого индикатора (HInd2-) имеет синюю окраску. С катионами металлов (Са2+, Mg2+, Zn2+ и др.) в слабощелочном растворе в присутствии аммиачного буфера (рН = 8-10) он образует комплексные соединения винно-красного цвета по схеме: 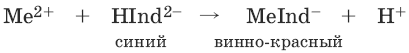 При титровании исследуемого раствора трилоном Б: 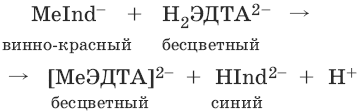 Константы нестойкости комплексов равны соответственно: Kн([CaInd]?) = 3,9 • 10-6 Kн([СаЭДТА]2-) = 2,7 • 10-11 Kн([MgInd]?) = 1,0 •1 0-7 Kн([MgЭДTA]2-) = 2,0 • 10-9 4.4. Жесткость воды. Определение жесткости воды Гидрокарбонатная (временная) жесткость обусловлена присутствием в воде бикарбонатов кальция и магния: Са(HCO3)2 и Mg(HCO3)2. Она почти полностью устраняется при кипячении воды, так как растворимые гидрокарбонаты при этом разлагаются с образованием нерастворимых карбонатов кальция и магния и гидроксо-карбонатов магния: Са(HCO3)2 = CaCO3v + CO2^ + H2O Mg(HCO3)2 = MgCO3v + CO2^ + H2O 2Mg(HCO3)2 = (MgOH)2CO3v + 3CO2^ + H2O Постоянная жесткость воды обусловлена присутствием в ней преимущественно сульфатов и хлоридов кальция и магния и при кипячении не устраняется. Сумма величин временной и постоянной жесткости составляет общую жесткость воды: Жобщ. = Жвр. + Жпост. Существуют различные способы определения жесткости воды: определение временной жесткости с помощью метода нейтрализации; комплексонометрический метод определения общей жесткости. Гидрокарбонатная жесткость воды определяется титрованием воды раствором соляной кислоты в присутствии метилового оранжевого, так как рН в точке эквивалентности находится в области перехода окраски этого индикатора. Са(HCO3)2 + 2HCl > CaCl2 + 2Н2CO3 Mg(HCO3)2 + 2HCl > MgCl2 + 2H2CO3 До начала титрования рН раствора гидрокарбонатов кальция и магния больше 7 за счет гидролиза солей с участием аниона слабой кислоты. В точке эквивалентности раствор имеет слабокислую реакцию, обусловленную диссоциацией слабой угольной кислоты: Н2CO3 - HCO3? + Н+ Жвр (Н2O) = сэ(солей) • 1000 (ммоль/л). Общая жесткость воды (общее содержание ионов кальция и магния) определяется с использованием метода комплексонометрии. 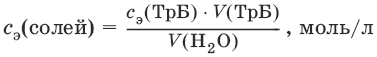 Жпост (Н2O) = сэ(солей) • 1000 (ммоль/л). 4.5. Методы редоксиметрии Методы редоксиметрии, в зависимости от используемых титрантов, подразделяются на: 1) перманганатометрию. Титрант – раствор перманганата калия КMnO4. Индикатор – избыточная капля титранта; 2) иодометрию. Титрант – раствор свободного иода I2 или тиосульфата натрия Na2S2O3. Индикатор – крахмал. Вычисление молярных масс эквивалентов окислителей и восстановителейПри вычисления молярных масс эквивалентов окислителей и восстановителей исходят из числа электронов, которые присоединяет или отдает в данной реакции молекула вещества. Для нахождения молярной массы эквивалента окислителя (восстановителя) нужно его молярную массу разделить на число принятых (отданных) электронов в данной полуреакции. 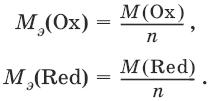 Например, в реакции окисления сульфата железа(II) перманганатом калия в кислой среде: 2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O 1 | MnO4? + 8Н+ + 5e > Mn2+ + 4H2O 5 | Fe2+ – e > Fe3+ ион MnO4? как окислитель принимает пять электронов, а ион Fe2+ как восстановитель отдает один электрон. Поэтому для расчета молярных масс эквивалентов окислителя и восстановителя их молярные массы следует разделить на пять и на один соответственно. 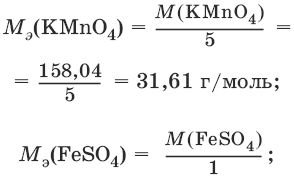 M3(Fe2+) = M(Fe2+) = 55,85 г/моль. В реакции окисления сульфита натрия перманганатом калия в нейтральной среде: 2KMnO4 + 3Na2SO3 + Н2O > 2MnO2 + 3Na2SO4 + 2KOH 2 | MnO4? + 2Н2O + Зe > MnO2 + 4OH? 3 | SO32- + 2OH? + 2e > SO42- + Н2O ион MnO4? принимает только три электрона, а ион восстановителя SO32- отдает два электрона, следовательно: 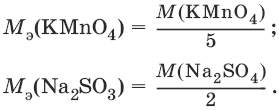 Молярные массы эквивалентов окислителей и восстановителей зависят от условий проведения реакций и определяются, исходя из соответствующих полуреакций. 4.6. Фотоколориметрия Фотоколориметрия – оптический метод анализа, который рассматривает взаимодействие вещества с электромагнитным излучением в видимой области: длина волны (?) 380–750 нм; волновое число (v) 2,5 104 – 1,5 • 104 см-1; энергия излучения (Е) 1—10 эВ. Поглощенное световое излучение количественно описывается законом Бугера–Ламберта-Бера: 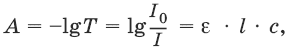 где А – поглощение вещества, или его оптическая плотность; Т – пропускание образца, т. е. отношение интенсивности света, прошедшего через образец, к интенсивности падающего света, I/I0; с – концентрация вещества (обычно моль/л); l – толщина кюветы (см); ? – молярная поглощательная способность вещества или молярный коэффициент поглощения [л/(моль см)]. Расчет молярного коэффициента поглощения проводят по формуле: ? = А/(с Ь). |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||
