|
||||
|
X «Исчезновение» материи: квантовая теория
Вторым революционным событием в физике XX в. по праву можно считать создание квантовой теории. И поныне мы не можем назвать ни одного другого научного открытия, которое столь решительно изменило бы наше представление о том, что реально в физическом мире и как ведет себя природа. При обсуждении квантовой теории мы не будем придерживаться хронологической последовательности событий и останавливаться на тех или иных математических достижениях или блестящих экспериментах. Дело в том, что используемая в квантовой теории математика далеко не элементарна; она включает в себя такие разделы, как теория дифференциальных уравнений и теория вероятностей. Изложить популярно столь высокие материи не просто. Но смею заверить читателя, что и в квантовой теории математика играет столь же важную роль и служит таким же незаменимым инструментом познания природы, как и в тех областях естествознания, о которых мы говорили раньше. Квантовая теория занимается изучением атомной структуры материи, и до сих пор не все проблемы и даже явные противоречия в ней разрешены. Мы все еще находимся на довольно ранней стадии развития в той области науки, которую часто называют микрофизикой в противоположность макрофизике, занимающейся, как правило, изучением крупномасштабных явлений. Квантовая теория «копает» гораздо глубже того уровня, о котором нам могут что-либо рассказать наши органы чувств, например зрение или осязание, так как даже в электронный микроскоп различимы только очень большие атомы. Квантовая теория занимается изучением невидимого безмолвного мира. И хотя этот мир сам по себе неощутим, производимые им эффекты столь же реальны, как стол, стул и наше собственное тело. Возможно, наиболее близко этому миру электромагнитное излучение. Мы не воспринимаем его физически, но его воздействие известно каждому. Вспомним, к примеру, радио или телевидение. Природа некоторых открытий квантовой теории не до конца понятна, тем не менее, они нашли практическое воплощение. Атомная бомба — реальность, и нам приходится считаться с ней гораздо больше, чем с некоторыми величайшими творениями математической мысли прошлого. Хотя наши ощущения убеждают нас в том, что звук, свет, вода и вещество в целом непрерывны, вопрос об элементарной структуре всех явлений (например, света) и вещества уходит своими корнями в античную эпоху. Еще Левкипп (V в. до н.э.) и вслед за ним Демокрит из Абдеры (ок. 460-370 до н.э.) учили, что материя состоит из неделимых атомов. (Само слово атом происходит от греческого «атомос» — неделимый.) Демокрит считал, что существует много разновидностей атомов, отличающихся по величине, форме, твердости и порядку положения. Большие тела состоят из множества атомов, отличающихся числом и расположением, но сами атомы неделимы. И Левкипп, и Демокрит заявляли, что все чувственные восприятия — лишь видимости, порождаемые различными расположениями атомов. В то время как форму, размеры и другие перечисленные выше качества древние атомисты считали реальными физическими свойствами атомов, остальные качества, такие, как вкус, тепло и цвет, по их мнению, не присущи самим атомам, а являются результатом воздействия атомов на человека. Чувственное знание ненадежно, ибо оно зависит от ощущения субъекта. Иных взглядов придерживался Аристотель. Согласно его учению, восходящему к Эмпедоклу (490-430 до н.э.), в основе всего лежат четыре элемента — земля, огонь, воздух и вода, свойства которых в той или иной степени присущи всем вещам. Комбинациями этих сущностей, возникающими под действием притяжения (любви) и отталкивания (ненависти), объясняются все явления в мире. В действительности древним грекам (и даже их предшественникам) были известны и другие элементы, например медь, олово и ртуть, но ни Аристотель, ни его последователи не брали их в расчет. Аристотель считал, что атомы делимы (даже бесконечно делимы), поэтому материя, по его мнению, непрерывна и мельчайших структурных частиц не существует. Взгляды Аристотеля господствовали в Европе, подавляя все иные воззрения, до XVI в. С XVII в. и вплоть до начала XX в. признание получила теория, согласно которой атомы неделимы. Предполагалось, что атомы различных химических элементов, например водорода, кислорода, меди, золота и ртути, различны. Считалось также, что атомы одного и того же элемента одинаковы по весу, а атомы различных элементов имеют разный вес. Обычные вещества, скажем, вода, состоят из молекул, представляющих собой комбинации различных атомов. Именно эти представления были положены в основу современной химии. Первые шаги к ее созданию предпринял Роберт Бойль (1627-1691) в сочинении «Химик-скептик» (1661). Более глубокое изложение основ химии (согласующееся со взглядами Бойля) предложил в 1803 г. Джон Дальтон (1766-1844). Основная идея Дальтона заключалась в следующем: многие законы химии можно без труда объяснить, если предположить, что каждому химическому элементу соответствуют специфические атомы. Каждое вещество состоит из определенных комбинаций различных «сортов» неделимые атомов. К 60-м годам XIX в. было известно около шестидесяти различных типов атомов. В том же десятилетии Дмитрий Иванович Менделеев (1834-1907) предпринял попытку классифицировать известные химические элементы, расположив их в порядке возрастание атомных весов. Он обратил внимание на то, что среди первых шестнадцати элементов химические свойства повторяются через семь элементов на восьмой. Менделеев обнаружил также, что если подмеченную им закономерность распространить на остальные элементы, расположенные в порядке возрастания атомных масс, то наблюдаемая повторяемость химических свойств наводит на мысль о необходимости оставлять в системе классификации кое-где «пустые клетки». Менделеев счел вполне обоснованным предположить, что такие «клетки» принадлежат пока еще неизвестным элементам. Необходимость поиска неведомых элементов не вызывала у Менделеева ни малейших сомнений, и вскоре было действительно открыто три новых элемента (называемые ныне скандием, галлием и германием), свойства которых Менделеев предсказал заранее, опираясь на установленную им систему периодичности химических свойств. Дальнейшие исследования внесли некоторые изменения в периодическую систему Менделеева, но открытая им последовательность элементов и поныне составляет основу современной периодической системы. Хотя Менделеев понимал, что не располагает физическим объяснением выявленной им закономерности в свойствах химических элементов, он всячески отстаивал важность использования закона периодичности для поиска новых элементов, определения их атомных масс и предсказания химических свойств, в частности способности образовывать соединения с другими элементами. Элементы, как известные ранее, так и предсказанные Менделеевым и обнаруженные впоследствии другими исследователями, расположены в порядке возрастания сложности строения их атомов и соответственно перенумерованы. Например, водород значится в периодической системе под номером 1. Под номером 2 стоит гелий, и так далее до элемента с номером 103 — лоуренсия. Атомные массы элементов показывают, во сколько раз атом данного элемента «тяжелее» атома водорода. Атомная масса водорода принята за 1, атомная масса гелия равна 4 и так далее до атомной массы лоуренсия, равного 257. Хотя спор о неделимости атомов продолжался до начала XX в., большинство естествоиспытателей склонялись к мнению, что атомы неделимы и являются мельчайшими составными частями материи. В 1907 г. Кельвин заявил, что атом неразрушим. Однако некоторые замечательные открытия ниспровергли утвердившееся было мнение о неделимости атома. В 70-х годах XIX в. становилось все более очевидным, что атом, возможно, состоит из каких-то более мелких частиц. В 1897 г. Джозеф Джон Томсон (1856-1940) экспериментально доказал, что атом действительно состоит из частиц, и, в частности, с высокой точностью измерил электрический заряд и массу очень легких заряженных частиц, получивших название «электрон». В 1900 г. Хендрик Антон Лоренц подтвердил существование таких отрицательно заряженных частиц. Масса электрона оказалась равной примерно 10?27 г (точнее 0,91•10?27 г), что почти в 2000 раз меньше массы самого легкого из атомов — водорода. Заряд электрона также невообразимо мал: около 4,80325•10?10 электростатических единиц. Примерно в 1903 г. Хантаро Нагаока в Токио предложил так называемую «модель Сатурна», согласно которой расположенное в центре ядро было окружено вращающимися вокруг него электронами. Это была первая попытка порвать с традиционным убеждением в неделимости атома. Атомная теория в те годы выглядела весьма примитивно. Она утверждала, что все атомы состоят из протонов (заряженных положительно) и электронов. Считалось, что протоны образуют ядро атома. Вскоре стало ясно, что масса атома почти полностью сосредоточена в ядре. Самое малое из ядер — ядро атома водорода — имеет массу 1,6726•10?24 г. Вокруг ядра любого атома располагаются электроны, число которых равно атомному номеру. Еще один удар по традиционной теории был нанесен в 1896 г., когда Антуан Анри Беккерель (1852-1908) совершенно случайно открыл радиоактивность. Изучением этого явления занялись супруги Пьер Кюри (1859-1906) и Мария Склодовская-Кюри (1867-1934). Стало очевидно, что атом обладает гораздо более сложной структурой, чем предполагалось. О природе радиоактивности мы расскажем чуть позднее. Но вскоре стало ясно, что ядра некоторых атомов, в частности очень тяжелых атомов, обладают способностью испускать частицы и электромагнитное излучение, получившие соответственно названия альфа- и бета-частиц и гамма-излучения. Альфа-частицы — это ионизованные атомы гелия, бета-частицы — электроны, а гамма-излучение — электромагнитное излучение очень высокой частоты. Выяснилось, что при испускании альфа-частицы атом превращается в атом более легкого элемента. В ранних работах по строению атома продукты радиоактивного распада использовались для изучения частиц, составляющих атомное ядро. К 1910 г. Эрнест Резерфорд (1871-1937), экспериментировавший с радиоактивными атомами, пришел к мысли, что атом по своему строению напоминает Солнечную систему, в которой вокруг расположенного в центре Солнца обращаются планеты. В модели атома Резерфорда вокруг расположенного в центре ядра по различным орбитам двигались электроны. Резерфорд был абсолютно уверен в том, что объем ядра не превышает «одной миллионной от одной миллионной» (т.е. 10?12) объема атома. Например, в атоме золота (атомный номер 79) вокруг ядра движется 79 электронов. Атомное ядро в модели Резерфорда состояло главным образом из протонов, о чем мы уже упоминали. Но для восполнения «недостающей» массы ядра Резерфорд предположил, что оно помимо протонов содержит также электрически нейтральные частицы, которые он назвал нейтронами. Ядра с одинаковым числом протонов, но разным числом нейтронов называются изотопами. Пока Резерфорд и другие исследователи изучали атом, строили его модели, Макс Планк (1858-1947) в 1900 г. совершил необычайно важное открытие, оказавшее влияние на все последующее развитие атомной физики. Планк занимался изучением так называемого теплового излучения, или излучения абсолютно черного тела. Известно, например, что раскаленный докрасна металл излучает свет, который, как мы знаем, является одной из разновидностей электромагнитного излучения. Опираясь в основном на интуитивные физические представления, Планк выдвинул в 1900 г. гипотезу (теоретически пока не обоснованную), согласно которой излучение испускается не сплошным, непрерывным «потоком», а небольшими порциями, или квантами, энергия которых зависит от частоты излучения, испускаемого атомом. Энергия излучения, согласно Планку, определяется по формуле
где n — число испущенных квантов, которое может быть равно 0, 1, 2, …; h — постоянная, называемая ныне постоянной Планка (h = 6,626•10?34 Дж•с = 6,686•10?27 эрг•c ~ 10?26 эрг•с), v — частота излучения, состоящего из квантов подобно тому, как, например, волны на воде состоят из молекул воды. Излучение, допустим, свет, кажется непрерывным, так как число образующих его квантов очень велико. Так, число квантов, испускаемых за 1 с обычной 100-ваттной электрической лампой, составляет порядка 1020. Падая на поверхность металла, свет с частотой v высвобождает энергию. Из формулы Планка следует, что энергия каждого электрона, выбитого из поверхности металла, пропорциональна hv. Позднее кванты излучения стали называть фотонами. Формула Планка была гипотезой, счастливой догадкой, плодом замечательной физической интуиции. Однако Планку понадобилось произвести немало математических выкладок, чтобы изложить свои рассуждения и хотя бы в какой-то мере придать им убедительность. Эйнштейн в своей работе по фотоэлектрическому эффекту (1905), в детали которой мы намеренно не будем входить, ибо это увело бы нас далеко в сторону, не только подтвердил формулу Планка, но и сумел найти ей применение. Свет, освещая поверхность металла, выбивает из нее электроны. Из гипотезы Планка следовало, что падающее на поверхность металла излучение состоит из квантов, каждый из которых несет энергию hv. Энергия каждого вылетевшего из металла электрона пропорциональна hv. Гипотеза квантов позволила Эйнштейну объяснить взаимодействие света и атомов, образующих поверхность металла. Выбивание электронов происходит только при достаточно высокой энергии квантов, т.е. при больших частотах, но не зависит от интенсивности света. Что же касается числа выбиваемых электронов, то оно действительно определяется интенсивностью света. Работы Планка и Эйнштейна вновь подняли проблему: из чего состоит электромагнитное излучение и, в частности, свет? Из волн или из частиц? К этой проблеме мы обратимся в дальнейшем. А пока заметим лишь то, что уже ясно из сказанного: электромагнитное излучение ведет себя и как волны, и как частицы. Но вернемся к работам, связанным с изучением структуры атома. Модель Резерфорда не позволяла объяснить, почему электроны, обращающиеся вокруг ядра, не испускают света или энергии какого-нибудь другого вида, как того требует теория электромагнитного поля, и не падают по спирали на ядро. Нильс Хенрик Давид Бор (1885-1962) «вгляделся» в структуру атома пристальнее, чем его предшественники. Приняв за исходную планетарную модель Резерфорда, Бор на основании некоторых математических соображений постулировал, что электроны в атоме не излучают, если движутся по вполне определенным («разрешенным») орбитам подобно тому, как движутся планеты. Обращающийся вокруг атомного ядра электрон обладает энергией, а именно механической энергией, которую имеет любой объект, обращающийся вокруг центрального тела. Но стоит лишь электрону перейти с одной орбиты на другую, как он либо испускает, либо поглощает излучение. И испускание, и поглощение энергии происходят скачками. Каждый скачок представляет собой квант энергии, его величина кратна hv. При поглощении атомом излучения электрон переходит с внутренней, более близкой к ядру, орбиты на внешнюю, — более далекую от ядра. При обратном переходе, напротив, атом излучает кванты, или фотоны. Теория Бора объясняла далеко не все результаты, касающиеся частот испускаемого атомами излучения, поэтому работа по выяснению структуры атома продолжалась. До сих пор речь шла о квантах, или фотонах, т.е. о «частицах» электромагнитного излучения. В 1922 г. на сцене появился Луи Виктор де Бройль (1892-1987); он высказал идею, которая стала центральной в разделе физики, получившем название «волновая механика». Зная о корпускулярных свойствах световых волн (о фотонах), де Бройль задумался над вопросом: если световые волны могут вести себя и как частицы, и как волны, то почему бы аналогичным образом не вести себя частицам? Нельзя ли с любым веществом связать волны? Следовало попытаться определить частоту и скорость волн материи. Пользуясь методами математической теории дифференциальных уравнений с частными производными, де Бройль установил, что длина волны ? к любой частицы должна быть равна постоянной Планка h, деленной на произведение массы частицы m и ее скорости v, т.е.
Произведение mv называется импульсом частицы и обычно обозначается p. Для частиц массой 1 г, движущейся со скоростью 1 см/с, длина волны де Бройля ? = 10?26 см, т.е. в 10 млн. раз меньше размеров атомного ядра. Следовательно, в шкале масштабов окружающего нас макроскопического мира все объекты чудовищно велики по сравнению с длинами соответствующих им волн материи, поэтому мы не наблюдаем этих волн. Развивая идею де Бройля о том, что всем микрочастицам и, в частности, электронам соответствуют волны, Эрвин Шрёдингер (1887-1961) вывел в 1926 г. дифференциальное уравнение с частными производными для так называемой ?-функции, описывающей форму этих волн. Решая уравнение Шрёдингера, мы находим параметры волн. Его решения называются собственными, или характеристическими, функциями. Если коэффициентам, входящим в уравнение Шрёдингера, придать конкретные численные значения, то эти функции отличны от тождественного нуля только при определенных значениях некоторой постоянной. Эти значения называются собственными, или характеристическими. Дискретные значения энергии электронов в атоме оказываются собственными значениями волнового уравнения Шрёдингера и согласуются с теми величинами, которые дает теория Бора. Следующая весьма грубая картина позволит нам хотя бы в общих чертах понять, как ведут себя волны электронов в представлении Шрёдингера. На рис. 38 показана часть волны протяженностью 2?. Если такую волну создать, проведя смычком по скрипичной струне, то она будет колебаться вверх-вниз, занимая положения, показанные сплошной и штриховой кривыми. Можно возбудить и некую последовательность волн, длины которых составляют лишь дробные части основной длины волны (например, половину и треть ее). В представлении Шрёдингера полная волна, соответствующая любому электрону, окружая ядро, может простираться на две, три и даже пять основных длин волн. В каждом случае в полной волне электрона укладывается целое число основных волн и конец последней волны совпадает с началом первой (на рис. 38 точка B должна совпадать с точкой A) 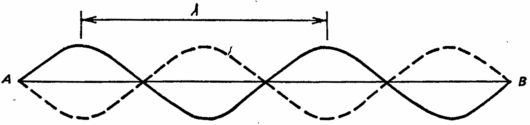
Введенная Шрёдингером ?-функция задает амплитуду волн материи, изменяющихся от точки к точке и от одного момента времени к другому. Это стоячие волны, сосредоточенные преимущественно в небольшой области пространства вблизи ядра. По мере увеличения расстояния от ядра волны постепенно затухают, но амплитуда их остается отличной от нуля в области, размеры которой совпадают с экспериментально установленными размерами соответствующего атома. Например, для атома водорода, находящегося в основном (самом нижнем) энергетическом состоянии, амплитуда волн заметно отлична от нуля только в пределах сферы диаметром около 10?8 см. Для любого атома решение волнового уравнения Шрёдингера позволяет получить дискретный набор волн атомных электронов, и с каждым состоянием атома оно связывает определенное значение энергии. Подчеркнем еще раз, что волна Шрёдингера, описывающая электрон в атоме, представляет не простую волну с одной-единственной частотой, а состоит из целого набора волн с различными частотами. В этом отношении волна Шрёдингера аналогична сложным звуковым волнам, создаваемым музыкальными инструментами. В связи с волнами де Бройля — Шрёдингера естественно напрашивается вопрос: из чего они «сделаны», или, иначе говоря, из чего они состоят? Подобный вопрос вставал перед физиками и в XIX в., когда было открыто световое и другие виды электромагнитного излучения. Сначала физики полагали, что электромагнитные волны представляют собой колебания таинственной субстанции, называемой эфиром, и придумывали различные механические модели, объясняющие действие эфира. Но со временем физики поняли несостоятельность такого рода идей и стали считать электромагнитные волны самостоятельными сущностями. Нечто похожее произошло и с волнами электронов. Первоначально Шрёдингер предположил, что эти волны действительно описывают распределение заряда электрона, т.е. что в атоме заряд и плотность электрона физически распределены в той области пространства, где амплитуда волны отлична от нуля. Но ничего подобного не наблюдалось. Наоборот, после открытия электрона выяснилось, что весь его заряд сосредоточен в небольшой области пространства и что электрон имеет корпускулярную природу. Строго говоря, когда мы рассуждаем о возможных видах волн, соответствующих различным энергетическим состояниям электрона, то имеем в виду один электрон, не испытывающий воздействия других частиц. Если же в атоме много электронов, то они утрачивают свою «индивидуальность» и соответствующие им волны сливаются в общую волну, «одну на все электроны». В представлении Шрёдингера электроны подобны облакам с переменной плотностью. Они трехмерны. Электронные облака образуют несколько «ярусов» вокруг ядра. Плотность каждого облака возрастает от нуля до максимума и снова убывает до нуля. Электронные облака простираются и за пределы атома, но для каждого электрона их плотность максимальна на таком расстоянии от ядра, которое предсказывается теорией Бора. Электронное облако как интерпретация абстрактного математического понятия с неизбежностью неточно. Представить себе наглядно без ущерба для точности ?-функцию Шрёдингера невозможно. Нахождение аналитических решений уравнения Шрёдингера — задача настолько трудная, что решить ее удается лишь в отдельных исключительных случаях. Тем не менее полученные решения превосходно согласуются с экспериментальными данными, а другие решения, хотя и приближенные, также достаточно хорошо соответствуют результатам экспериментов. В частности, удалось полностью решить уравнение Шрёдингера для случая атома водорода. Полученное решение позволяет ответить на любой вопрос, допускающий экспериментальную проверку. То, что электроны при определенных условиях ведут себя как волны, было продемонстрировано в 1927 г. знаменитым экспериментом Клинтона Дж. Дэвиссона (1881-1958) и Лестера Джермера (1896-1971) и независимо Джорджем П. Томсоном (1892-1975). Все эти исследователи обнаружили дифракцию электронов (в качестве дифракционной решетки использовался кристалл) Дифракция как явление, состоит в том, что волны огибают встречающееся на пути препятствие и заходят за него в область «тени». Нечто подобное мы наблюдаем, когда волны на воде огибают корпус судна. Опыты Дэвиссона и Джермера, а также Томсона показали, что в некоторых случаях частицы ведут себя как волны. Физики окончательно убедились в том, что всем субатомным частицам соответствуют свои волны, длины которых определяются формулой де Бройля. Так, работы де Бройля и Шрёдингера выдвинули на передний план понятие корпускулярно-волнового дуализма (волна — частица), доставившее немало хлопот и физикам, и философам. Несмотря на экспериментальное подтверждение того, что электроны при определенных условиях ведут себя как волны, далеко не все физики смирились с представлением об электронах, «размазанных» вокруг атомного ядра. Некоторые усматривали, в частности, противоречие в следующем: с одной стороны, в любой физически бесконечно малой области плотность заряда электрода должна быть бесконечно мала, а с другой — электрический заряд электрона является величиной вполне определенной. Все электрические заряды кратны заряду электрона. Руководствуясь этими соображениями и пытаясь избежать корпускулярно-волнового дуализма, Макс Борн (1882-1970) в 1926 г. предложил совершенно иную интерпретацию теории Шрёдингера: ввел ее вероятностную интерпретацию. Теория вероятностей вошла в математику благодаря случаю, а именно в связи с задачами об азартных играх. Но в конце XIX в. Максвелл и Людвиг Больцман (1844-1906), воспользовавшись в своих исследованиях вероятностными соображениями, пришли к законам, описывающим движение газов, — к кинетической теории газов. Одна из знаменитых работ, опубликованных Эйнштейном в 1905 г., также была посвящена вероятностной задаче о так называемом броуновском движении. Вместо того чтобы рассматривать электрон как распределенный в некоем пространственном облаке, плотность которого меняется от точки к точке, Борн интерпретировал плотность как вероятность обнаружить электрон как частицу в той или иной точке пространства. Обращаясь к ?-функции, входящей в дифференциальное уравнение Шрёдингера, Борн предложил трактовать величину ? как вероятность того, что частица находится в данном элементе пространства в данный момент времени. Следовательно, местонахождение электронов как частиц может быть указано лишь с большей или меньшей вероятностью. Например, если в некоторой области пространства |?|2 = 0,8, то вероятность обнаружить частицу (электрон) в ней составляет 80 шансов из 100. Вероятностная интерпретация Борна общепринята и поныне. Такой подход позволяет точно оценивать, с какой вероятностью электрон может находиться в любом данном объеме. При подобной интерпретации электрон локализован, а не «размазан», как в волновой механике Шрёдингера. Тем не менее остается вопрос, является ли вероятностная интерпретация наилучшей из возможных или же она просто порождена неполнотой наших представлений об электроне. Использование вероятности может показаться отчаянной попыткой спасти положение, но статистическая механика убедительно доказала ценность вероятностного подхода. Любой газ представляет собой совокупность множества хаотически движущихся молекул, однако давление газа и другие его свойства удается вычислять на основе наиболее вероятных значений, и эти параметры имеют физический смысл. Эйнштейн, Планк и Шрёдингер выступали против вероятностной интерпретации квантовой механики. Свои возражения Эйнштейн, в частности, изложил в 1955 г., аргументируя их ссылкой на приближенный характер и неполноту квантовой теории:
Хотя вероятностная интерпретация квантовой теории получила широкое признание, в душе некоторых физиков робко теплилась надежда на то, что будущие исследования все же откроют возможность точного и достоверного определения положения электрона в пространстве. Но одна из принципиально новых особенностей квантовой теории как раз и состоит в неизбежности некоторого индетерминизма. Мы имеем в виду принцип неопределенности, открытый в 1927 г. Вернером Гейзенбергом (1901-1976). Грубо говоря, принцип неопределенности утверждает, что невозможно получить одновременно точную информацию и о положении, и о скорости (или импульсе) частицы. Точнее Гейзенберг показал, что произведение неопределенностей в оценке положения и импульса должно быть не менее h/2? (?x•?p ? h = h/2?). Гейзенберг был убежден в правильности сформулированного им принципа и объяснял его тем, что частицы обладают и волновыми, и корпускулярными свойствами. И положение, и импульс частицы можно измерить сколь угодно точно, но только не одновременно, а порознь — либо координату, либо импульс. Тогда же Гейзенберг высказал предположение, что при столь тонких измерениях, как квантовомеханические, становится существенным сам объект, посредством которого производится измерение, — пробная частица. Этот источник неопределенности начинает играть важную роль потому, что при измерении положения или импульса, например, электрона в качестве пробной частицы можно использовать только либо другие электроны, либо фотоны, но и те и другие оказывают сильное воздействие на исследуемую частицу. Следовательно, в мире атома мы не можем наблюдать явления, не создавая при этом возмущения. Так как положение и скорость микрочастиц невозможно измерить одновременно сколь угодно точно, мы лишены возможности точно предсказывать их поведение. И нам не остается ничего другого, как довольствоваться вероятностными предсказаниями. Наблюдения и эксперименты классической физики здесь ничем не помогут. Если бы постоянная Планка была достаточно велика, то квантовая неопределенность распространялась бы и на макроскопические явления. Например, мы не могли бы с уверенностью сказать, попадет ли снайпер в мишень, даже тщательно прицелившись. Но вследствие крайне малой величины постоянной Планка между квантовомеханическим миром и нашей макроскопической реальностью нет прямого соответствия. Неопределенность внутренне присуща волновой механике. Что же касается наблюдаемых макроскопических объектов, то неопределенность в определении их положения и импульса очень мала и потому практически неощутима. Квантовомеханический принцип неопределенности подрывает классическую концепцию объективности, т.е. идею о том, что мир находится во вполне определенном состоянии независимо от наблюдения его. Квантовомеханический подход противоречит нашему повседневному опыту, свидетельствующему в пользу классической концепции объективности, согласно которой мир продолжает существовать своим путем, даже если мы не воспринимаем его. Просыпаясь утром, мы застаем мир примерно таким, каким оставили его накануне вечером. Что же касается квантовомеханической интерпретации принципа неопределенности, то она приводит к иному выводу: стоит вглядеться в мир пристальнее (на атомном уровне), как окажется, что его состояние зависит и от того, каким именно образом мы его наблюдаем и что выбираем за объект наблюдения. Классический идеал объективной реальности нуждается в пересмотре с учетом реальности, создаваемой наблюдателем. В дальнейшем усилия ученых, занимающихся исследованием структуры атома, сосредоточились в основном на атомном ядре. Явление радиоактивности давало основания считать, что ядро атома отнюдь не является неделимой частицей. Радиоактивные атомы испускают альфа-, бета- и гамма-излучение. Альфа-излучение представляет собой поток альфа-частиц, имеющих положительный электрический заряд, по абсолютной величине вдвое больший заряда электрона, и массу, в четыре раза превосходящую массу атома водорода. Бета-излучение — это поток бета-частиц, т.е. электронов. Наконец, гамма-излучение есть не что иное, как «жесткое» электромагнитное излучение, т.е. характеризующееся самыми высокими из известных частот. Все три вида излучения испускают ядра тяжелых атомов. Последующие экспериментальные исследования структуры атомного ядра, производимые главным образом на ускорителях — своего рода «молотах», способных расколоть атомное ядро, — показали, что ядро действительно не является цельным, неделимым образованием, а состоит из множества различных частиц: протонов, нейтронов, пионов, состоящих в свою очередь из кварков. Сообщения об открытии новых частиц продолжают поступать и поныне: анализируя результаты экспериментов, физики приходят к выводу о существовании той или иной частицы. Многие частицы, входящие в состав атомного ядра, определенным образом связаны между собой, но для наших целей вполне достаточно того, что они существуют. Хотя атомное ядро образуют самые различные частицы, основными «строительными блоками» всякого вещества остаются протоны и нейтроны. Из них на 99,99 % состоят наши тела. Ядра всех элементов, которые тяжелее водорода, помимо протонов содержат нейтроны. Некоторые структурные единицы атомных ядер, как и электроны, обладают волновыми свойствами. В частности, это относится к ядрам атомов водорода и гелия. Вместе с тем при столкновениях ядра ведут себя как частицы. Множество частиц, как входящих в состав атомного ядра, так и существующих самостоятельно, обладают еще одним удивительным свойством: они способны претерпевать превращения. Например, протон может превращаться в нейтрон с испусканием нейтрино и позитрона, обладающего такой же массой, как электрон, но имеющего положительный заряд, равный по абсолютной величине заряду электрона. (Существование позитрона предсказал в 1932 г. Поль А.М. Дирак (1902-1984), руководствуясь чисто теоретическими соображениями.) Возможно и обратное превращение: нейтрон, испуская электрон и нейтрино, переходит в протон. Квант электромагнитного поля, или фотон, — если он обладает достаточной энергией — может, взаимодействуя с электрическим полем атомного ядра, породить пару электрон — позитрон. Существует и обратный процесс, в котором электрон и позитрон при соударении исчезают (аннигилируют), образуя два фотона. Таким образом, можно сказать, что способность претерпевать разнообразные превращения является основным свойством элементарных частиц, многие из которых нестабильны и получаются в лаборатории или образуются в космическом излучении. Протоны и электроны, насколько это известно в настоящее время, относятся к стабильным частицам, т.е. не распадаются на другие элементарные частицы. Правда, современные гипотетические модели так называемого Великого объединения предполагают, что протон претерпевает распад, но, видимо, не чаще, чем примерно раз за 1030 лет. Картина микромира еще более усложняется существованием античастиц. Это группа элементарных частиц, массы и ряд других физических характеристик которых имеют ту же величину, что и у их «двойников», в то же время некоторые их характеристики (например, электрический заряд) противоположны по знаку. Как уже говорилось, при столкновении электрона и позитрона образуются два и более фотонов. Столкновение протона и антипротона приводит к возникновению мезонов. Подобно тому как из частиц строится вещество, из античастиц может быть построено антивещество. До сих пор мы ни словом не обмолвились о силах, действующих между частицами. Что удерживает протоны в ядре? Ведь, имея одноименные (положительные) заряды, они должны были бы испытывать электростатическое отталкивание. Помимо уже известных нам взаимодействий, гравитационного и электромагнитного, физики постулировали существование слабого и сильного взаимодействий; последнее и удерживает протоны и нейтроны в ядре. Разработанная в 70-е годы теория электрослабого взаимодействия указывает на единую природу электромагнитного и слабого взаимодействий (она получила убедительное экспериментальное подтверждение). Ученые ведут исследования по созданию так называемой теории Великого объединения, унифицирующей сильные, слабые и электромагнитные взаимодействия. К чему же мы пришли после многочисленных попыток создать связную картину микроскопического мира? Понятия и выводы квантовой механики ниспровергают все привычные основы. Они ставят наш «здравый смысл» перед неразрешимыми проблемами, отрицают его или по крайней мере бросают ему вызов. Прежде чем пытаться как-то «сгладить» наши первые впечатления, отметим, что к реальности, с которой имеет дело квантовая теория, следует относиться со всей серьезностью. Мы знаем, что теория атомных структур в полном ее объеме позволяет многое объяснить в строении молекул и даже в химических процессах. Однако существуют более ощутимые и наглядные реальности: атомная бомба, принцип действия которой основан на делении атомных ядер, и водородная бомба, основанная на термоядерном синтезе. При столкновении атома урана с нейтроном, происходит деление атома урана, при этом часть его массы превращается в огромное количество энергии. При определенных условиях процесс деления может протекать как цепная реакция. На этом принципе основано действие атомной бомбы и ядерного реактора. Такого рода реальность мы уже наблюдали. Противоположный процесс происходит при термоядерном синтезе, которым еще нужно научиться управлять. Если четыре ядра обычных атомов водорода сливаются в один атом гелия, масса которого чуть меньше учетверенной массы водорода (равна 3,97 атомной массы водорода), то огромное количество энергии выделяется в виде света и тепла. Процесс термоядерного синтеза с превращением водорода в гелий непрерывно происходит на Солнце; именно он является источником солнечной энергии. В земных условиях для термоядерного синтеза используют изотопы водорода — дейтерий и тритий, атомные массы которых соответственно в два и три раза больше массы обычного, «легкого», водорода. Осуществление термоядерного синтеза тяжелого водорода требует невероятно высоких температур. Интересно, что еще в 1920 г. Оливер Лодж высказал поистине пророческую мысль: «Настанет время, когда атомная энергия придет на смену углю… Я надеюсь, что человеческий род начнет применять эту энергию не раньше, чем у него достанет ума использовать ее должным образом». Но Резерфорд еще в 1933 г. считал мысль об использовании атомной энергии абсурдной. В нашем, по необходимости, беглом обзоре процессов в микромире мы, помимо прочего, отмечали, что материя в виде частиц может превращаться в излучение (волны) и наоборот, в то же время их квантовомеханическое описание исходит из того, что материя в виде частиц в определенных условиях проявляет волноподобные свойства, а излучение — частицеподобные. Но что же в таком случае представляет собой «подлинная» физическая реальность? Так, фотон не является волной в традиционном смысле. Это волна-частица, единое образование, обладающее двойственной природой: и волны, и частицы. Аналогичным образом электрон не является частицей в традиционном смысле, это волна-частица. Как именно ведет себя фотон или электрон — как волна или как частица, — зависит исключительно от того, какой эксперимент мы производим над ними. Ни электрон, ни фотон не ведут себя только как волна или только как частица. Если мы ставим эксперимент по дифракции света, то фотон ведет себя как волна. Но если с тем же светом мы исследуем фотоэффект, то фотон ведет себя как частица. В электронных лампах или в телевизионных кинескопах электроны ведут себя как частицы. Но стоит лишь пропустить пучок электронов через кристалл, как мы получим интерференционные эффекты — такие же, как в случае световых волн. В своей книге «Физика и философия» Гейзенберг писал: «Мы наблюдаем не природу саму по себе, а природу в том виде, в каком она открывается нашему умению ставить вопросы». Естественно спросить: есть ли в таком случае сколько-нибудь существенные различия между частицей-волной и волной-частицей? Такие различия имеются, причем их достаточно много. Наиболее фундаментальное различие опять же связано со скоростью света. В то время как волна-частица никогда не достигает скорости света (в противном случае ее масса обратилась бы в бесконечность), частица-волна, будучи световой волной, имеет скорость, в точности равную скорости света. Частица-волна фотон не может иметь отличную от нуля массу покоя (т.е. обладать массой, если фотон не движется), ибо при движении со скоростью света масса фотона была бы бесконечной. Что же касается волны-частицы, то ее масса покоя не равна нулю. Можно назвать и другие различия. Однако в данном случае нам важно подчеркнуть тот основной вывод, к которому вплотную подводит нас современное развитие физики элементарных частиц в симбиозе с космологией, а именно, что все вещество в наблюдаемой нами Вселенной нестабильно. Атомные ядра могут превращаться в лептоны, например в электроны, позитроны, кванты электромагнитного излучения (фотоны) и т.д. В свою очередь элементарные частицы могут исчезать и возникать, превращаясь друг в друга. К этому еще следует добавить, что мы живем в расширяющейся Вселенной. Естественно возникает вопрос: а есть ли вообще в этой изменчивой картине разнообразных трансформаций нечто вечное, неизменное и стабильное? На этот счет высказываются разные мнения. Во всяком случае субстанция, в ее традиционном понимании неуничтожимая, делимая, телесная, твердая и протяженная, исчезла из наших рук и более не существует. Мы располагаем лишь некоторой совокупностью массы и энергии. Общая сумма их сохраняется, но любое из ее слагаемых может превращаться в другое. Например, при некоторых взаимодействиях частиц (скажем их столкновения в ускорителях) рождаются новые частицы, но наряду с ними присутствуют и частицы, находившиеся в пучке с самого начала. Как такое возможно? Энергия, сообщаемая частице в ускорителе, превращается в массу. Как известно, энергия и масса связаны между собой формулой Эйнштейна E = mc2. Всюду, где присутствует энергия, присутствует и масса. Энергия и масса — взаимодополняющие проявления реальности, не поддающиеся наглядной интерпретации. Не всякое макроскопическое описание применимо к микроскопическим явлениям, как и не всякий вопрос, имеющий смысл в рамках ньютоновской физики, имеет разумный ответ в области атомных явлений. Но коль скоро вся материя состоит из квантов и частиц, то почему мы не замечаем их в повседневной жизни? По той простой причине, что даже пылинка окажется горой по сравнению с любой субатомной частицей. Если бы такие частицы двигались даже с очень малой скоростью (с какой они никогда не движутся), то и тогда длина волны де Бройля была бы слишком незначительна, чтобы заметить эффекты квантования движения. Есть все основания утверждать, что когда мы выходим за рамки мира атомных явлений и приближаемся к миру обычных макроскопических явлений, квантовые понятия переходят в понятия классические. Последние действуют в мире промежуточных масштабов, или мезомасштабов, но не применимы ни к атомному, ни к космологическому мирам. Квантовая теория с большой точностью предсказывает результаты экспериментов. Но в рамках ее адекватное понимание физических процессов пока не достигнуто. Например, квантовая теория описывает электрон математически, с помощью волновой функции. Электрон «размазан» по пространству. Его волновая функция задает вероятность, с которой электрон может быть обнаружен в любой заданной точке пространства. Но, будучи обнаружен, электрон перестает быть «размазанным»: его положение становится вполне определенным. Можно ли считать такую картину корректной? Квантовая теория правильно предсказывает положения стрелок приборов, но лежащие в основе физические явления остаются неясными. Работают математические правила, а разумная интерпретация квантового мира, как ни печально, отсутствует. По-видимому, для описания реальности нужны и волны, и частицы. Порядок Вселенной может быть также и порядком нашего разума. Мы не просто наблюдатели реальности, мы — ее активные участники. Природа — не открытая книга, которую мы можем читать как независимые наблюдатели. Такой отказ от привычных требований физического объяснения заставил многих физиков и философов усомниться в том, что мы располагаем адекватным описанием атомных явлений. В частности, вероятностное описание, по их мнению, надлежит рассматривать как временную меру, на смену которой придет описание детерминистическое. Не следует забывать, однако, о том, что квантовая теория возникла сравнительно недавно. Вполне возможно, что через какие-нибудь пятьдесят лет неуклюжий гибрид корпускулярной и корпускулярно-волновой теорий превратится в простую и ясную теорию. Много из того, что мы знаем о различных частицах, почерпнуто из «пунктирных следов», оставленных ими в различного рода регистрирующих устройствах. Такие следы возникают при бомбардировке частицами мишеней в ускорителях. С другой стороны, в ускорителях бомбардирующие частицы приобретают огромную энергию, и можно было бы заключить, что эта энергия превращается в массу. Можно ли считать рождающуюся таким образом массу подлинной реальностью или перед нами обманчивое ощущение, рожденное нашими ненадежными и поверхностными чувственными восприятиями? Если не вдаваться в подробности, то массу заведомо следует считать статистическим эффектом. Как видим, понимание структуры атома имеет первостепенное значение для физики, но оно приносит поистине неоценимую пользу и химии, и биологическим исследованиям. Возможно, биохимии удастся раскрыть секреты жизни и наследственности и тем самым укрепить здоровье человека и продлить его жизнь. Как бы то ни было, можно с уверенностью сказать, что исследования природы атома оказались весьма плодотворными. Для нас наиболее существенно было понять, что наши модели структуры атома не физические. Они от начала и до конца математические. Математика позволяет открыть и установить порядок там, где царил хаос. По словам Дирака и Гейзенберга, непротиворечивое математическое описание природы — путь к истине в физике. Необходимость наглядного представления или физического объяснения — не более чем пережиток классической физики. |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||
