|
||||
|
ЛЕКЦИЯ № 8. Заболевания органов дыхания. Пневмония Пневмония – острое инфекционно-воспалительное заболевание, имеющее очаговый характер, при котором в патологический процесс вовлекаются респираторные отделы и интерстициальная соединительная ткань легких. Классификация Е. В. Гембицкого (1983 г.). По этиологии: 1) бактериальные (с указанием возбудителя); 2) ирусные (с указанием возбудителя); 3) корнитозные; 4) риккетсиозные; 5) микоплазменные; 6) грибковые; 7) смешанные; 8) инфекционно-аллергические; 9) неустановленной этиологии. По патогенезу: 1) первичные (самостоятельный острый воспалительный процесс); 2) вторичные (осложнение болезней сердечно-сосудистой системы с нарушением кровообращения в малом круге, хронические болезни почек, системы крови, обмена веществ, инфекционные болезни или развиваются на фоне хронических заболеваний органов дыхания). Клинико-морфологическая характеристика: 1) паренхиматозные (для пневмококковой пневмонии): крупозные; очаговые; 2) интерстициальные. По локализации и протяженности: односторонние; двусторонние. По тяжести: крайне тяжелые; тяжелые; средней тяжести; легкие и абортивные. По течению: острые; затяжные (рентгенологическое и клиническое разрешение пневмонии). Этиология. Большинство пневмоний имеет инфекционное происхождение. Пневмонии аллергические и обусловленные действием физических или химических факторов встречаются редко. Бактериальные пневмонии диагностируются чаще у лиц среднего и пожилого возраста; вирусные пневмонии – у молодых. В этиологии первичных бактериальных пневмоний ведущая роль принадлежит пневмококкам. В период эпидемии гриппа возрастает роль вирусно-бактериальных ассоциаций (чаще стафилококков), а также условно-патогенных микроорганизмов. При вторичных пневмониях ведущую этиологическую роль играют грамотрицательные бактерии (клебсиелла пневмонии и палочка инфлюэнцы); в возникновении аспирационных пневмоний велико значение анаэробной инфекции. Патогенез. Инфекционный возбудитель попадает извне в респираторные отделы легких через бронхи: ингаляционно и аспирационно (из носо– или ротоглотки). Гематогенным путем возбудитель попадает в легкие преимущественно при вторичных пневмониях или при тромботическом генезе пневмоний. Лимфогенное распространение инфекции с возникновением пневмонии наблюдается лишь при ранениях в грудную клетку. Имеется также эндогенный механизм развития воспаления в легочной ткани, обусловленный активацией микрофлоры, находящейся в легких. Роль его велика при вторичных пневмониях. Развитию пневмонии способствуют неблагоприятные факторы внешней и внутренней среды, под влиянием которых происходят снижение общей неспецифической резистентности организма (подавление фагоцитоза, выработки бактериолизинов и пр.) и подавление местных защитных механизмов (нарушение мукоцилиарного клиренса, снижение фагоцитарной активности альвеолярных макрофагов и нейтрофилов и др.). Существенное значение в патогенезе пневмоний придается также аллергическим и аутоаллергическим реакциям. Сапрофиты и патогенные микроорганизмы, становясь антигенами, способствуют выработке антител, которые фиксируются на клетках слизистой оболочки дыхательных путей, где происходит реакция антиген – антитело, которая приводит к повреждению тканей и развитию воспалительного процесса. При наличии общих антигенных детерминант микроорганизмов и легочной ткани или при повреждении легочной ткани вирусами, микроорганизмами, токсинами и токсичными веществами, приводящем к проявлению ее антигенных свойств, развиваются аутоаллергические процессы. Эти процессы способствуют более длительному существованию патологических изменений и затяжному течению болезни. Клиническая картина. Основные синдромы: 1) интоксикационный (общая слабость, разбитость, головные и мышечные боли, одышка, сердцебиения, бледность, снижение аппетита); 2) синдром общих воспалительных изменений (чувство жара, озноб, повышение температуры тела, изменение острофазрвых показателей крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличение СОЭ, уровня фибриногена, ?2-глобулинов, появление С-реактивного белка); 3) синдром воспалительных изменений легочной ткани (появление кашля и мокроты, укорочение перкуторного звука), усиление голосового дрожания и бронхофонии, изменение частоты и характера дыхания, появление влажных хрипов, рентгенологические изменения; 4) синдром вовлечения других органов и систем. Степень выраженности этих проявлений характеризует тяжесть течения пневмонии (см. табл. 11). Таблица 11 Симптомы и течение пневмонии 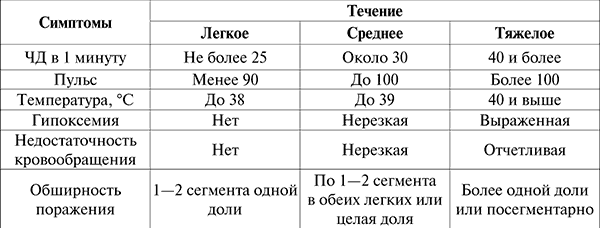 На различных этапах течения пневмонии клиническая картина может изменяться от присоединения тех или иных осложнений: легочных и внелегочных. Легочные: абсцедирование; плеврит (пара– и метапневмонический), реже – эмпиема плевры; присоединение астматического компонента, возможно формирование отека легких и развития острой дыхательной недостаточности. Внелегочные осложнения: инфекционно-токсический шок (с явлениями острой сосудистой, острой левожелудочковой и почечной недостаточности, изъязвлениями слизистой оболочки пищеварительного тракта и кровотечением, развитием диссеминированного внутрисосудистого свертывания крови; инфекционно-аллергический миокардит; инфекционный эндокардит; перикардит; менингит или менингоэнцефалит; нефрит; гепатит. При тяжелом течении крупозной пневмонии возможно развитие интоксикационных психозов, а при сливных тотальных пневмониях – острого легочного сердца. Основные жалобы больного пневмонией: на кашель, выделение мокроты, боли в грудной клетке, усиливающиеся при дыхании и кашле, одышку, нарушение общего самочувствия, повышение температуры тела. Кашель может быть сухим или с выделением мокроты (слизистой, слизисто-гнойной, гнойно-слизистой, кровянистой). «Ржавая» мокрота характерна для крупозной пневмонии, кровянистая – для пневмоний, вызванных клебсиеллой (палочка Фридлендера) и вирусной пневмонии; гнойная кровянистая мокрота свидетельствует о пневмонии стрептококкового генеза. Упорный кашель с небольшим количеством слизисто-гнойной мокроты наблюдается при микоплазменных пневмониях, для которых также характерно чувство саднения в горле. Боль в боку, усиливающаяся при глубоком дыхании и кашле, характерна для крупозной пневмококковой пневмонии, а также вовлечения в патологический процесс плевры. При локализации пневмонии в нижних отделах легких и вовлечении в процесс диафрагмальной плевры боль может иррадиировать в брюшную полость, симулируя картину острого живота. Если в процесс вовлечен верхний или нижний язычковый сегмент левого легкого, боли локализуются в области сердца. У 25 % больных жалоба на одышку является одной из основных, особенно при пневмонии, развившейся на фоне хронических заболеваний органов дыхания и сердечной недостаточности. Выраженность одышки нарастает параллельно нарушению общего самочувствия. Симптомы выраженной интоксикации наиболее характерны для корнитозной и микоплазменной пневмоний, наблюдаются и при стафилококковых, гриппозных и пневмококковых (крупозных) пневмониях. Больного могут беспокоить озноб и повышение температуры тела до фебрильной. На общем фоне интоксикации и фебрильной температуры появляются местные симптомы. Диагностика. Для постановки этиологического диагноза имеет значение правильная оценка симптомов заболевания в самом его начале. Осиплость голоса или невозможность разговаривать характерны для пневмоний, вызванных вирусом парагриппа. Слезотечение, резь в глазах, боль в горле при глотании, обильное выделение из носа без изменения других отделов дыхательных путей встречаются при пневмониях, вызванных аденовирусом. Наиболее значимым для диагноза является наличие синдрома воспалительных изменений легочной ткани. Этот синдром составляют следующие симптомы: 1) отставание при дыхании пораженной стороны грудной клетки; 2) укорочение перкуторного звука в области проекции поражения на большем или меньшем протяжении; 3) усиление голосового дрожания и бронхофонии в той же зоне; 4) изменение характера дыхания (жесткое, бронхиальное, ослабленное и т. п.); 5) появление патологических дыхательных шумов (влажные звонкие мелкопузырчатые хрипы и крепитация). Характер дыхания может изменяться по-разному. В начальной стадии крупозной пневмонии дыхание может быть ослабленным, с удлиненным выдохом; в фазе опеченения наряду с нарастанием тупости перкуторного звука прослушивается бронхиальное дыхание; при разрешении пневмонического очага с уменьшением перкуторной тупости дыхание становится жестким. При очаговой пневмонии наиболее постоянными симптомами являются жесткое дыхание и влажные звонкие мелкопузырчатые хрипы. Однако при центральных прикорневых пневмониях физикальные данные представлены очень скудно, и распознавание пневмонии оказывается возможным лишь после рентгенологического исследования. Скудностью физикальных данных отличаются микоплазменные пневмонии. Тяжелая интоксикация в сочетании с очень малым числом хрипов наблюдается при пневмонии, вызванной клебсиеллой пневмонии. В ряде случаев при аускультации на первый план может выступать большое количество басовых и дискантных сухих хрипов, нехарактерных для синдрома воспалительной инфильтрации. Это встречается при пневмониях, развившихся на фоне хронических бронхитов; пневмониях, вызванных палочкой Пфейффера; в случае присоединения к пневмонии аллергического компонента. Поставить этиологический диагноз помогают симптомы: 1) обнаружение мелкопятнистой, как при краснухе, сыпи в сочетании с лимфоаденопатией характерно для аденовирусной инфекции; 2) локальное увеличение лимфатических узлов говорит о перифокальной пневмонии; 3) грибковые пневмонии сочетаются с поражением слизистых оболочек, кожи и ногтей; 4) гепатолиенальный синдром и небольшая желтуха встречаются при корнитозных и Ку-риккетсиозных пневмониях; 5) для типичных крупозных пневмоний характерен вид больного: бледное лицо с лихорадочным румянцем на стороне поражения, герпетические высыпания, раздувание крыльев носа при дыхании. Наиболее важным методом, позволяющим уточнить наличие пневмонии и степень вовлечения в процесс легочной ткани, является крупнокадровая флюорография и рентгенологическое исследование органов грудной клетки. Четкой сегментарностью поражения легких с вовлечением в процесс нескольких сегментов отличаются стафилококковые пневмонии. Их характерным рентгенологическим признаком является образование на 5—7-й день от начала болезни множественных полостей в легких типа пневмоцеле, а в дальнейшем – некротических полостей с наличием жидкости. В отличие от истинных абсцессов конфигурация и количество полостей быстро меняются. Долевое поражение – проявление крупозной пневмонии или пневмонии, вызванной клебсиеллой. Чаще поражается верхняя доля, преимущественно правого легкого. Рентгенологическое исследование позволяет выявить выпот в плевральной полости. Часто такой выпот встречается при стрептококковых пневмониях, при пневмонии, вызванной палочкой Пфейффера, которая локализуется в нижней доле и у 2/3 пациентов захватывает более одной доли легкого. Особенно важны данные рентгенологического обследования при выявлении пневмонии со слабо выраженными аускультативными изменениями (интерстициальные и прикорневые пневмонии). В ряде случаев для уточнения диагноза показано проведение томографии и бронхографии, которые помогают уточнить диагноз в случаях замедленного обратного развития инфильтративных изменений, при осложненном течении (абсцессе, выпоте в плевральной полости). Они применяются для исключения других патологических процессов со сходными клинической и рентгенологической картинами. Бронхография выявляет полости распада в легочной ткани, а также наличие бронхоэктазов, вокруг которых при обострении возможны инфильтративные изменения (перифокальная пневмония). В диагностике инфарктной пневмонии определенную роль играет радионуклидное исследование легочного кровотока, выявляющее его нарушения. Бактериологическое исследование мокроты (или бронхиальных смывов) до назначения антибиотиков помогает обнаружить возбудитель и определить его чувствительность к антибиотикам. Не всегда выявленный микроорганизм является возбудителем пневмонии. Уточненный этиологический диагноз может быть поставлен с помощью иммунологических исследований: реакции связывания комплемента (РСК) и реакции торможения гемагглютинации (РТГА) с вирусными и бактериальными антигенами. В диагностике вирусных и вирусно-бактериальных пневмоний имеют значение вирусологические и серологические исследования (результаты культурального исследования мокроты, включая биологическую пробу на мышах, метод культивирования вирусов в развивающемся курином эмбрионе, метод иммунофлюоресценции, серологический метод с использованием парных сывороток против вирусов, придают значение лишь 4-кратному нарастанию титра антител). Исследование мокроты помогает уточнить природу пневмонии. Большое число эозинофилов свидетельствует об аллергических процессах, наличие атипических клеток – о пневмонии ракового генеза; микобактерии туберкулеза обнаруживают при туберкулезе; эластические волокна – свидетельство распада легочной ткани. При микозных пневмониях наряду с обнаружением грибов отмечается отсутствие гноеродной флоры вследствие угнетающего действия продуктов жизнедеятельности грибов. По данным микроскопии мазков мокроты, окрашенных по Грамму, можно говорить о грамотрицательных или грамположительных микроорганизмах, обитающих в бронхах уже в первые сутки пребывания больного в стационаре. Об остроте воспалительного процесса судят по выраженности острофазовых показателей крови и их динамике (лейкоцитоз со сдвигом лейкоцитарной формулы, увеличение СОЭ, повышенное содержание ?2-глобулинов, фибриногена, появление СРВ, повышение уровня сиаловых кислот). При затяжном течении пневмонии и развитии осложнений изучают иммунологическую реактивность организма. Снижение показателей гуморального (IgМ) и клеточного (задержка миграции лейкоцитов, изменение тестов, характеризующих систему Т-лимфоцитов) иммунитета требует проведения иммуномодулирующей терапии. Лечение. Непосредственно после постановки диагноза необходимо приступать к этиотропной терапии пневмонии. Большое значение приобретают эмпирические представления о возможном возбудителе, поскольку бактериологическое исследование мокроты проводится в течение достаточно длительного времени и у большинства больных даже при современном подходе к данному исследованию дает неопределенные, а иногда ошибочные результаты. На данный момент пенициллины утратили свое значение как препарат выбора в терапии пневмоний. Это связано с тем, что этиологически значимыми для развития пневмоний, кроме пневмококка и гемофильной палочки, являются и облигатные внутриклеточные микроорганизмы – Mycoplasma pneumoniae и Chlamydia pneumoniae, которые устойчивы к бактерицидному воздействию антибиотиков группы ?-лактамов. Нельзя упускать из виду и тот факт, что к данным препаратам у пациентов быстро формируется гиперчувствительность. В связи с вышесказанным в терапии пневмоний существенное внимание уделяют макролидам, которые доказали свою эффективность не только против пневмококка, но и в отношении Mycoplasma pneumoniae, Chlarnydia pneumoniae. Однако важно не упускать из виду и тот факт, что эритромицин, являющийся эталоном данной группы препаратов из-за своей низкой устойчивости в кислой среде (а значит, и низкой биодоступности), а также широкой распространенности штаммов пневмококка, резистентных к эритромицину, теряет свое клиническое значение. В качестве препаратов выбора его сменили другие препараты класса макролидов – азитромицин, рокситромицин, ровамицин и др. Ряд макролидов используется и для перорального и парентерального применения (например, ровамицин). Как следствие, оправдано их применение тяжелом течении воспалительного процесса в легком (например, изначально в течение 2–3 дней ровамицин назначается внутривенно капельно, а в последующем, при положительной динамике патологического процесса, пациент переходит на прием данного препарата внутрь). Неоспоримо преимущество ровамицина, поскольку, что он не вступает во взаимодействие с теофиллинами, при этом предотвращая возможность передозировки этих препаратов, так как теофиллины и ровамицин используются совместно при лечении больных с хроническими обструктивными заболеваниями легких. Известно также, что данная подгруппа макролидов (16-членные макролиды) является препаратами с минимальным уровнем побочных эффектов. У пациентов старше 65 лет вследствие неоднородности этиологического спектра пневмоний и при сопутствующих хронических обструктивных заболеваниях легких полусинтетические пенициллины могут быть использованы для инициальной антибиотикотерапии, а при отсутствия положительного эффекта после данной терапии в течении 3–4 дней оправдано применение цефалоспоринов. Важно напомнить, что спектр действия цефалоспоринов I и некоторых II поколения – это грамположительные и грамотрицательные микроорганизмы, а цефалоспорины III поколения действуют в основном на грамотрицательные возбудители. I поколение цефалоспоринов представлено цефалотином (кефлин), цефазолином (кефзол) и др. К препаратам II поколения относятся цефуроксим (кетоцеф), цефокситин (бонцефин) и др. III поколение цефалоспоринов: цефотаксим (клафоран), цефоперазон (цефобид), цефтриаксон (лонгацеф). Аспирационные пневмонии ассоциированы с анаэробной или грамотрицательной микрофлорой, что определяет использование аминогликозидов или цефалоспоринов III поколения в комплексе с метронидазолом-семисукцинатом (внутривенно капельно по 500 мг 2–3 раза в сутки). Иммунодефицитные состояния также влияют на характер выбранных препаратов, который при этом зависит от природы возбудителя. В таких случаях применяемая схема складывается из аминогликозидов и современных цефалоспоринов. Продолжительность эффективной антибактериальной терапии пациента с пневмонией – 7—10 суток. При назначении лечения следует учитывать, что в 7—15 % случаев возможно и отсутствие эффекта от данной терапии. Это говорит о необходимости замены антибиотиков, опираясь на результаты микробиологического исследования. Другим вариантом является использование альтернативных препаратов, так называемых антибиотиков второго выбора: современные цефалоспорины, имипенемом, монобактамы, фторхинолоны. Фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксацин) эффективны в отношении грамотрицательных возбудителей, включая Pseudomonas aeruginosa, и некоторых грамположительных кокков (Staphylococcus aureus), однако неактивны при действии на анаэробы. Фторхинолоны оправданно можно рассматривать как альтернативу макролидам при хламидиозной, легионеллезной и микоплазменной инфекциях. Монобактамные антибиотики в современном виде представлены азтреонамом (азактамом), который активен в основном в отношении грамотрицательных аэробов (сальмонеллы, шигеллы, протей, кишечная палочка, клебсиелла и др.); а также устойчив при действии ?-лактамаз. Имипенем – антибактериальный препарат группы карбапенемов, назначается только в комплексе с циластатином, ингибирующим метаболизм имипенема. Препарат высокоэффективен в отношении многих анаэробов, грамположительных кокков и грамотрицательных палочек. Дозирование антибиотиков, используемых в лечении пневмоний. 1) Пенициллины: бензилпенициллин (500 000—1 000 000 ЕД внутривенно каждые 6–8 ч или по 500 000—1 000 000 ЕД каждые 4 ч внутримышечно), ампициллин (0,5–1,0—2,0 г внутримышечно каждые 6–8 ч или 0,5 г каждые 6 ч внутривенно), амоксициллин (0,5–1,0 г каждые 8 ч перорально или 0,5–1,0 г каждые 8—12 ч внутримышечно, внутривенно), оксациллин (0,5 г каждые 4–6 ч перорально, внутримышечно, внутривенно). 2) Цефалоспорины: I поколение – цефалотин (кефлин) (0,5–2,0 г каждые 4–6 ч внутримышечно, внутривенно), цефазолин (кефзол) (0,5–2,0 г, каждые 8 ч внутримышечно, внутривенно), II поколение – цефуроксим (зинацеф, кетоцеф) (0,75—1,5 г каждые 6–8 ч внутримышечно, внутривенно), III поколение – цефотаксим (клафоран) (1,0–2,0 г, максимально до 12 г/сутки каждые 12 ч внутримышечно, внутривенно), цефтриаксон (лонгацеф, роцефин) (1,0–2,0—4,0 г каждые 24 ч внутримышечно, внутривенно). 3) Аминогликозиды: генетамицин (80 мг каждые 12 ч внутримышечно, внутривенно), амикацин (10–15 мг/кг каждые 12 ч внутримышечно, внутривенно), тобрамицин (бруламицин) (3–5 мг/кг каждые 8 ч внутримышечно, внутривенно). 4) Макролиды: эритромицин (0,5 г каждые 6–8 ч перорально или 0,5–1,0 г каждые 6–8 ч внутривенно), ровамицин (3,0 млн МЕ каждые 8—12 ч перорально или 1,5–3,0 млн ME каждые 8—12 ч внутривенно). 5) Фторхинолоны: пефлоксацин (лефлацин) (400 мг каждые 12 ч перорально, внутривенно), ципрофлоксацин (ципробай) (500 мг каждые 12 ч перорально или 200–400 мг каждые 12 ч внутривенно), офлоксацин (заноцин, таривид) (200 мг каждые 12 ч перорально). 6) Тетрациклины: доксициклин (вибрамицин) (200 мг в 1-й день, в последующие дни – по 100 мг каждые 24 ч перорально), миноциклин (миноцин) (200 мг в 1-й день, в последующие дни – по 100 мг каждые 12 ч перорально), азтреонам (азактам) (1,0–2,0 г каждые 8—12 ч), имипенем / цилстатин (тиенам) (500 мг каждые 6–8 ч внутримышечно). Существенным является и тот факт, что, как правило, затяжное или прогрессирующее течение заболевания обусловлено неадекватной инициальной антибактериальной терапии. Однако, помимо этого, выделяют еще ряд местных и системных причин, которые ведут к длительному и упорному течению воспаления в легких: это локальная обструкция дыхательных путей (рак, аденома, мукоидная закупорка и др.); бронхоэктазия (врожденная, приобретенная); кистозный фиброз; дефекты иммунной системы (приобретенные); рецидивирующая аспирация (ахалазия, рак пищевода и др.); активация латентной туберкулезной инфекции; формирующийся абсцесс легкого; неадекватная антибактериальная терапия. |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||
