|
||||
|
12. Химические реакции. Скорость, энергетика и обратимость 12.1. Скорость реакций Количественной характеристикой быстроты течения химической реакции А + B > D + E является ее скорость, т. е. скорость взаимодействия частиц реагентов А и В или скорость появления продуктов D и Е. Изучением скорости химических реакций занимается особый раздел химии — химическая кинетика. В гомогенных (однородных) системах исследуется скорость реакции между реагентами, не имеющими границы раздела (газовые реакции, реакции в растворах). В гетерогенных системах изучается скорость реакции на поверхности раздела между реагирующими веществами (например, А – твердое вещество, В – газ или А – твердое вещество, В – вещество в растворе). Для гомогенных систем скорость реакции – это изменение концентраций реагентов или продуктов в единицу времени: 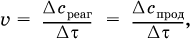 где v – скорость реакции, моль/(л с); ?cреаг = (с'реаг – с"реаг) ? уменьшение концентрации реагентов, моль/л, за промежуток времени ?? = ?2 – ?1; ?cпрод = (с"прод – с'прод) – увеличение концентрации продуктов, моль/л, за тот же промежуток времени. В начальный момент времени (? = 0) концентрация реагентов наибольшая, а концентрация продуктов равна нулю. В процессе реакции концентрация реагентов уменьшается, а концентрация продуктов растет. К факторам, влияющим на скорость реакции, относятся природа реагентов, катализатор, температура, концентрация реагентов. 1. Природа реагентов. Здесь большую роль играет характер химических связей в соединениях, строение их молекул. Например, выделение водорода цинком из раствора хлороводорода происходит значительно быстрее, чем из раствора уксусной кислоты, так как полярность связи Н – Cl больше, чем связи О – Н в молекуле СН3СООН; иначе говоря, из-за того, что НCl – сильный электролит, а СН3СООН – слабый электролит в водном растворе. Чем больше поверхность соприкосновения реагирующих веществ, тем быстрее протекает реакция. Поверхность твердого вещества может быть увеличена путем его измельчения или растворения (если вещество растворимо). Реакции в растворах протекают практически мгновенно. 2. Катализаторы. Большое влияние на скорость реакции оказывают катализаторы – вещества, увеличивающие скорость реакции (часто от нуля до очень больших значений), но не входящие в состав продуктов. Увеличение скорости реакции под влиянием катализаторов называется катализом. Во многих случаях катализаторы образуют с одним из реагирующих веществ промежуточное соединение, которое реагирует с другим исходным веществом, в результате получается продукт и высвобождается катализатор. Иногда употребляют отрицательные катализаторы — ингибиторы, которые, наоборот, замедляют нежелательные химические реакции (например, коррозию металлов). 3. Температура. Для газовых реакций известно, что при повышении температуры на десять градусов (?Т = 10 К или ?t = 10 °C) скорость реакции возрастает в 2–4 раза (правило Вант-Гоффа). Для скорости реакции ?2 и ?1 при значениях температуры t2 и t1 имеем: ?2 = ?1 ?0,1(t2-t1), где ? – температурный коэффициент скорости реакции, ? = 2–4. Для реакций в растворах скорость также увеличивается с ростом температуры и часто в той же мере, как и для газовых реакций. При повышении температуры возрастает число активных молекул, т. е. таких молекул, которые в момент столкновения обладают большей энергией и могут образовать продукты. Как показывают исследования, активных молекул в реакционной среде при обычных условиях очень мало. Иначе все реакции между газами протекали бы мгновенно, и в воздухе не было бы, например, свободного кислорода, необходимого для дыхания. Реакции между газами при обычных условиях практически не идут (встречаются исключения, например, при 20 °C полностью протекает реакция 2NO + O2 = 2NO2). 4. Концентрация реагентов. Чтобы произошло взаимодействие, частицы реагирующих веществ в гомогенной среде должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в объеме реактора, т. е. молярным концентрациям этих веществ. Чем большие количества веществ взяты для реакции в данном объеме системы, т. е. чем выше концентрация реагентов, тем больше число столкновений частиц и тем больше скорость реакции. Зависимость скорости реакции от концентрации реагентов распространяется на газовые смеси и растворы. Установлено, что: Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов если для реакции необходимо столкновение двух реагирующих молекул. Эта зависимость носит название кинетического закона действующих масс (К. Гулльберг, П. Воге, 1867) Для гомогенной реакции А + В >… этот закон изображается уравнением ? = kcAcB, где k – константа скорости реакции [л/(моль с)], зависящая от природы реагентов, присутствия катализатора и температуры, но не зависящая от концентрации реагентов и численно равная скорость реакции при условии сАсв = 1. Для гетерогенной реакции А + В(ж, т) >… взаимодействие происходит лишь на поверхности конденсированного (жидкого, твердого) вещества, поэтому концентрация такого вещества не входит в выражение закона действующих масс: ? = kcA. Для реакций, уравнения которых не отражают механизма протекания этих реакций, необходимо рассматривать каждую элементарную стадию отдельно. Тройные и более столкновения (А + В + В +… >) маловероятны, поэтому такие реакции (например, N2 + ЗН2 = 2NH3) протекают всегда в несколько элементарных стадий (А + В >). Кинетический закон действующих масс применим только к каждой из этих стадий, но не к уравнению химической реакции в целом. 12.2. Энергетика реакций Любая реакция сопровождается выделением или поглощением энергии в форме теплоты. В исходных веществах химические связи разрываются, и на это энергия затрачивается (т. е. она при этом поглощается системой), в продуктах же, наоборот, химические связи образуются, и при этом энергия выделяется. Разность между затраченной и выделившейся энергией называется тепловым эффектом химической реакции (обозначается Q). Если затрата энергии выше, чем ее выделение, то тепловой эффект будет отрицательным, или эндо-эффектом (-Q) в противном случае – положительным, или экзо-эффектом (+Q). Тепловой эффект является внешним признаком реакций, в термохимических уравнениях он указывается после продуктов: 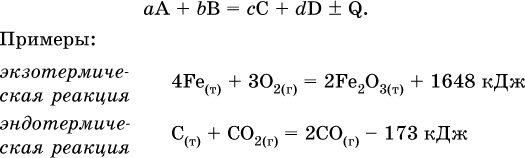 Такая запись означает, что при сгорании 4 моль железа в 3 моль кислорода с образованием 2 моль оксида железа (III) выделяется 1648 кДж теплоты, а при взаимодействии 1 моль углерода (в виде кокса) и 1 моль углекислого газа с получением 2 моль угарного газа поглощается извне 173 кДж теплоты. Тепловые эффекты прямой и обратной реакций одинаковы по числу, но противоположны по знаку. Например, реакция 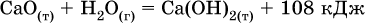 (обработка 1 моль оксида кальция водяным паром в количестве 1 моль с образованием 1 моль гидроксида кальция) сопровождается экзо-эффектом Q = +108 кДж, тогда как обратная реакция 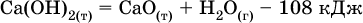 (разложение 1 моль гидроксида кальция на 1 моль оксида кальция и 1 моль водяного пара) сопровождается эндо-эффектом Q = -108 кДж. При протекании реакций (особенно с участием газов) могут существенно меняться объем и температура реакционной системы. Если тепловой эффект определяется при постоянном давлении (1 атм для каждого газа в системе, а при отсутствии газов общее давление 1 атм) и постоянной температуре (обычно 298 К, или 25 °C), то он отвечает стандартной энтальпии реакции, характеризующей в целом всю систему (функция системы). Энтальпия реакции обозначается ?Н°, знак ?Н° противоположен знаку Q: 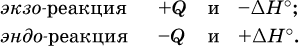 Значение ?Н° записывается после уравнения и отделяется от него запятой: 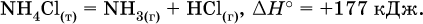 Реакции, протекающие с высоким экзо-эффектом, часто требуют только начального нагревания (инициирования), а далее протекают самопроизвольно, например процесс алюминотермии: 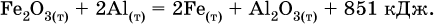 Помимо энтальпии, химическая система характеризуется еще одной функцией – стандартной энтропией реакции ?S° (кДж/К), связанной с неупорядоченностью системы (степенью беспорядка). Чем больше частиц в системе и чем выше ее температура, тем больше степень беспорядка. В идеальном кристалле (при абсолютном нуле температуры) степень беспорядка нулевая (идеальный порядок), в реальных твердых телах существует всегда некоторая степень беспорядка, в жидкостях она уже выше, но наибольшая степень беспорядка в газах, где молекулы не зависят друг от друга и двигаются весьма хаотично. Например, для льда, жидкой воды и водяного пара значения ?S° равны соответственно 0,039, 0,07 и 0,189 кДж/К. Всякая химическая реакция, таким образом, имеет две энергетические характеристики – энтальпию ?Н° и энтропию ?S°. Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет теплопередачи в окружающую среду и одновременно к увеличению степени беспорядка. Эти факторы действуют в противоположных направлениях, поэтому результирующая величина будет равна их разности: 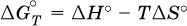 (здесь энтропия умножена на температуру для адекватности единиц, ?Н° и T?S° приведены в килоджоулях, так как К кДж/К = кДж). Суммарная энергетическая функция системы называется стандартной энергией Гиббса реакции ?G°T, индекс Т подчеркивает зависимость этой величины от температуры, что очевидно из уравнения (отметим еще, что ?Н° и ?S° мало зависят от температуры). По значениям G°T можно судить о возможности протекания реакций в направлении слева направо по химическому уравнению: 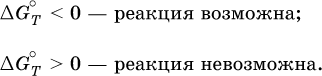 Например, синтез аммиака 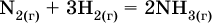 при 25 °C возможен: 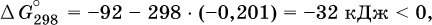 а при 350 °C невозможен: 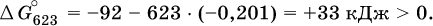 Следовательно, при 25 °C имеется принципиальная возможность получения аммиака, а при сильном нагревании системы (реакция экзотермическая, ?Н° = -92 кДж) аммиак получить не удастся. Правда, при 25 °C реакция возможна только в принципе, так как она протекает очень медленно и с малым выходом. Ускорение реакций определяется факторами химической кинетики, а увеличение степени протекания – соответствующим смещением химического равновесия. 12.3. Обратимость реакций Химическая реакция называется обратимой, если в данных условиях протекает не только прямая реакция (>), но также и обратная реакция т. е. из исходных веществ образуются продукты и одновременно из продуктов получаются реагенты: 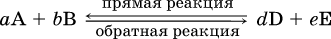 Обратимые реакции не доходят до конца. Концентрации реагентов уменьшаются, что приводит к уменьшению скорости прямой реакции Когда скорости прямой и обратной реакций станут одинаковыми ( В состоянии равновесия концентрации реагентов и продуктов постоянны, их называют равновесными концентрациями и обозначают [А], [В], [D] и [Е], в отличие от концентраций сА, св, cD и сЕ в любой другой момент времени. Установлено, что: В состоянии равновесия произведение концентраций продуктов в степенях, равных стехиометрическим коэффициентам, деленное на такое же произведение концентраций реагентов, есть величина постоянная при T = const. Такое соотношение обозначают Кс и называют константой равновесия данной реакции: 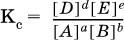 Это выражение носит название равновесный закон действующих масс (К. Гулльберг, П. Воге, 1867). Значение Кс характеризует состояние равновесия в данной реакции и определяется соотношением концентраций, т. е. величина Кс не зависит от каждой в отдельности равновесной концентрации – [А], [В], [D] или [Е]. Химическое равновесие не означает, что наступило состояние покоя. Прямая и обратная реакции протекают и в состоянии равновесия, но с одинаковой скоростью. Поэтому оно называется подвижным (динамическим) равновесием. Подвижное химическое равновесие можно нарушить, оказывая на систему внешнее воздействие и тем самым изменяя условия протекания реакции – температуру, давление, концентрацию. При любом нарушении (сдвиге) химического равновесия система перейдет (сместится) в другое состояние равновесия. Влияние условий на смещение химического равновесия определяется принципом, который установлен французским ученым A.-Л. Ле-Шателье (1884). Современная формулировка принципа смещения равновесия, называемого принципом Ле-Шателье: При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию. Рассмотрим подробнее влияние таких факторов, как температура, давление, концентрация, на смещение равновесия. 1. Температура. Повышение температуры смещает равновесие обратимой реакции в сторону процесса, идущего с поглощением теплоты (эндотермическое направление), а понижение температуры – в сторону процесса, идущего с выделением теплоты (экзотермическое направление). Для экзотермической реакции: 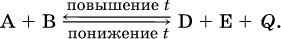 Для эндотермической реакции: 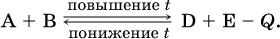 Значение Кс обязательно изменится при повышении и понижении температуры, так как значения констант скорости k прямой (>) и обратной (<) реакций по-разному зависят от температуры, ведь это реакции между разными реагентами (соответственно А и В или D и Е). Следовательно, константа равновесия – функция температуры: Kc = ?(t) Примеры: а) повышение температуры (нагревание): 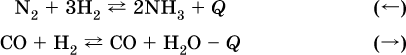 б) понижение температуры (охлаждение): 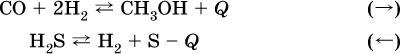 2. Давление. Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров). Увеличение давления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшением объема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличением объема: а) 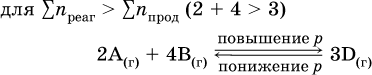 б) 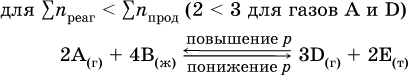 При ?nреаг = ?nпрод изменение не вызовет смещения равновесия. Примеры гомогенных реакций: а) увеличение давления (сжатие): 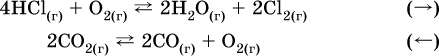 б) уменьшение давления (расширение): 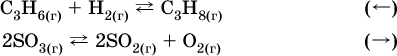 Примеры гетерогенных реакций (коэффициенты перед формулами конденсированных веществ не учитываются): а) увеличение давления (сжатие): 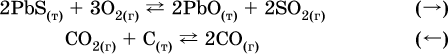 б) уменьшение давления (расширение): 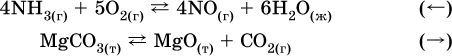 В реакциях с равными количествами газообразных реагентов и продуктов (здесь 2 = 2 в обоих примерах): 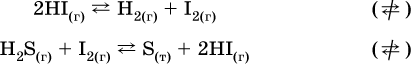 сдвиг равновесия наблюдаться не будет. 3. Концентрация. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации этого вещества равновесие смещается в сторону образования данного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия. Для некоторой реакции: 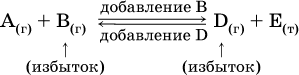 Смещение равновесия вправо можно было вызвать добавлением избытка реагента А (вместо В), а смещение влево возможно только избытком продукта D (другой продукт – твердое вещество). Этот вывод следует непосредственно из равновесного закона действующих масс: 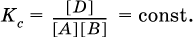 При добавлении в систему газа D равновесие сместится влево т. е. при протекании обратной реакции так увеличится содержание газов А и В, что соотношение концентраций останется постоянным и равным Кс. Отметим еще раз, что добавление конденсированного вещества (здесь твердого Е) не повлияет на состояние равновесия (сдвиг равновесия добавлением Е невозможен). Примеры: а) при добавлении аммиака равновесие сместится вправо: 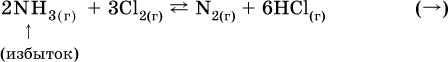 б) при добавлении водорода равновесие сместится влево: 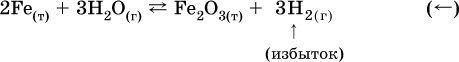 Примеры заданий части А Примеры заданий части А1. Гетерогенные реакции – это 1) Н2 + I2(г) > HI 2) Fe2(SO4)3(т) > Fe2O3(T) + SO3 3) Zn + H2SO4 > ZnSO4 + H2^ 4) CO + H2 > CO + H2O (nap) 2. При взаимодействии H2 с Cl2, Br2 и I2 в сосудах равного объема через 27 с образуется по 0,04 моль продуктов. Скорость реакции 1) выше для I2 2) выше для Cl2 3) одинакова 4) выше для Br2 3. Для гомогенной реакции А + В >… при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет 1) в 2 раза 2) в 3 раза 3) в 6 раз 4) в 9 раз 4—6. Скорость реакции 4. 2CuО(т) + СО >… 5. 2FeO(т) + С(т) >… 6. N2 + 2С(т) + Н2 >… при V = const и увеличении количества веществ в 4 раза изменится так: 1) возрастет в 4 раза 2) возрастет в 8 раз 3) возрастет в 16 раз 4) не изменится 7—8. Равновесие смещается вправо (>) при 7. нагревании 8. охлаждении реакционных систем 1) 2СО + O2 2) 2HI + 3) N2 + O2 4) 2Н2 + O2 9. Равновесие реакции этерификации СН3СООН + С2Н5ОН можно сдвинуть вправо (>) 1) добавлением серной кислоты 2) добавлением едкого натра 3) нагреванием 4) добавлением воды 10. Равновесие в гетерогенной реакции СаО(ст) + СО2 1) добавлении СаО 2) добавлении СаСO3 3) сжатии 4) нагревании 11. Выход продукта в реакции CaS(т) + 2O2 можно увеличить 1) добавлением CaS 2) нагреванием 3) введением катализатора 4) повышением давления 12. Доменный процесс Fe2O3 + ЗСО 1) увеличивается 2) уменьшается 3) не изменяется 4) не знаю |
|
|||
|
Главная | Контакты | Прислать материал | Добавить в избранное | Сообщить об ошибке |
||||
|
|
||||

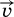 . Скорость же обратной реакции
. Скорость же обратной реакции 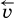 постоянно возрастает, поскольку увеличиваются концентрации продуктов.
постоянно возрастает, поскольку увеличиваются концентрации продуктов.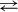 2СO2 + Q
2СO2 + Q